📑오늘 우리가 살펴볼 연구는?
Di-Iacovo, N., Ferracchiato, S., Pieroni, S., Scopetti, D., Castelli, M., Piobbico, D., Pierucci, L., Gargaro, M., Chiasserini, D., Servillo, G., & Della-Fazia, M. A. (2024). HOPS/TMUB1 Enhances Apoptosis in TP53 Mutation-Independent Setting in Human Cancers. International journal of molecular sciences, 25(9), 4600.
🤔 연구의 시작점
p53은 스트레스에 대한 세포 반응 조절, 사합체에서 전사요소로서 작용하고 세포질에서는 단량체(monomer)로서 작용하며, 항상성 세포 프로그램과 산화방지 스트레스, 자가포식, 신진대사 조절의 기원이 되는 매우 중요한 단백질이에요!
특히나 종양 억제 메커니즘에서 세포주기 정지, 세포사멸, 노화등 다양한 프로그램의 활성에 관여해 세포 증식을 조절한다는 점에서 중요하죠!
p53 종양 억제 단백질을 코딩하는 유전자에 돌연변이가 생기면 종양 발생과 직결될 수 있기 때문이에요! 실제로 50% 이상 암에서 TP53에 돌연변이가 존재한답니다 😭
p53 돌연변이 중 대부분은 missense 돌연변이로 나타나고있어요. TP53 DBD arginine의 R175,R213, R248, R273, R282 위치에서 돌연변이가 아주 빈번하답니다!
p53 안정성에 가장 중요한 조절자는 E3 ubiquitin ligase MDM-2인데, 최근 다른 유비퀴틴이나 탈 유비퀴틴 효소, 유비퀴틴 유사단백질이 p53의 기능과 국소화, 안정성을 조절하는 것이 밝혀졌어요! 이에 따라 유비퀴틴 유사(UBL) 단백질인 HOPS/TMUB1이 세포 증식 조절에 관여하는 여러 단백질들의 안정성을 조절하는 능력을 가지고 있어 연구 대상이 되었어요!
HOPS?
유비퀴틴 유사 단백질로, 세포주기의 단계와 유전독성, 산화, 방사선 등과 같은 세포 스트레스에 따라 핵에서 세포질로 이동해요!
유비퀴틴 유사단백질로서 뉴클레오포스민(NPM)과 상호작용해 종양 억제제 p19와 그 핵소체의 위치를 안정화해요. HOPS에 의해 안정화된 p19Arf 는 TP53의 과발현을 일으키게돼요! TRAF6 조절을 통해 NF-kB의 염증성 반응을 조절하는데, 최근 HOPS는 관련된 다양한 종양의 예후와 PD-L1 반감기에 영향을 미치는 면역 checkpoint 조절자로서 주목받고있어요!
p53은 적절히 apoptosis가 일어나도록 하는 종양 억제제로서 작용하는데, HOPS는 p53에 결합할 뿐 아니라, p53을 세포질 내 유비퀴틴화로부터 보호해 p53이 분해되지 않도록 돕는다고 해요!
따라서 미토콘드리아에 p53이 유지되며 반감기가 연장되며 축적되고, apoptosis를 일으키게 되죠! 반대로 HOPS 결핍시엔 DNA 손상후 p53-의존 apoptosis가 감소하는 결과로 이어져요!
➡️ HOPS는 p53과 결합해 반감기를 연장시키고 적절한 apoptosis가 일어나도록 돕는 역할
😉 이번 연구의 진행 방향
HOPS가 p53에 결합하고 보호한다는 특징을 바탕으로, 변이된 p53 형태인 mutated p53(mutp53)에도 결합할 수 있는지 확인하고, 이에 따라 p53 관련된 전사 의존적/비의존적 apoptosis에 영향 미치는지 확인하고자 함.
- 인간 암의 mutated p53와 HOPS의 상관관계 평가
- Pan-cancer Atlas 데이터시트 교차점검을 통해 p53 서열에서 가장 빈번히 일어나는 세 부위의 돌연변이 서열 선택 : R175, R248, R274
- p53 돌연변이가 가장 빈번한 위치에서 돌연변이가 나타난 유방, 췌장, 폐 세가지 장기에서 파생된 세포주 선택
➡️ HOPS 과발현이 apoptosis를 결정하는지 조사
➡️ 선택된 암세포주들에서 HOPS-p53이 결합하는지 조사
➡️ 인간 암에서 HOPS와 mutated p53 형태 (mutp53)간의 가능한 메커니즘, 상호작용 탐구
🔍✨ 연구 결과 살펴보기
1️⃣ DBD Missence Mutations of TP53 per se Are not sufficient to Justify the Deregulation of its signaling pathway
: TP53의 DBD내 missense mutation은 p53 경로의 과활성/저활성(deregulation) 충분히 정의할 수 없다
TP53내 돌연변이는 암에서 가장 흔한 유전적 변이 현상이며, 암을 구분하는 방법으로 사용되고있어요! TCGA 환자에 대해 Pan-Cancer dataset 분석 결과, TP53 돌연변이는 deleterious, splice, missense로 나뉘고, missense mutation이 대부분(65%)을 차지한다고 해요!
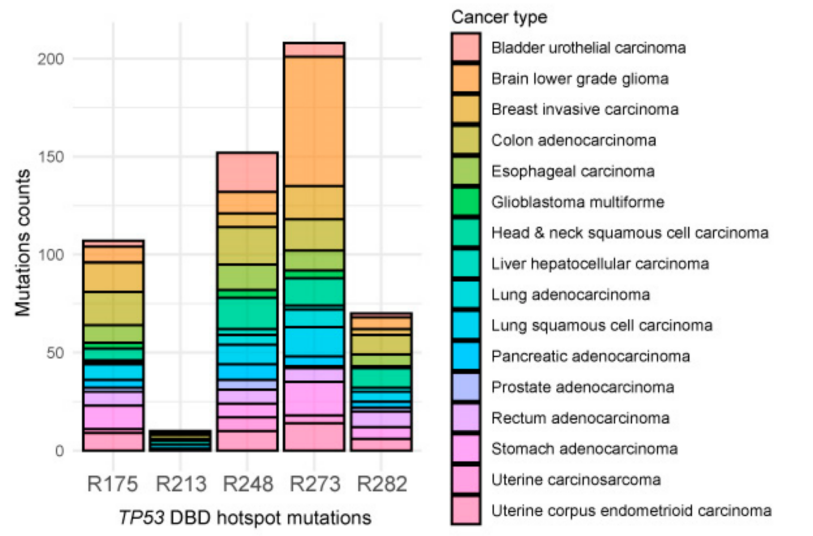
Arginine (p53을 이루는 아미노산 中 1)에서 missense 돌연변이를 갖는 환자별 TP53 PARADIGM score 비교했을 때, p53 DBD에서 가장 빈번히 돌연변이가 일어나는 'hotspots'는 R175, R248, R273으로 나타남에 따라 이 위치에서의 돌연변이들이 p53 경로에 미치는 효과를 확인하고자 해요!
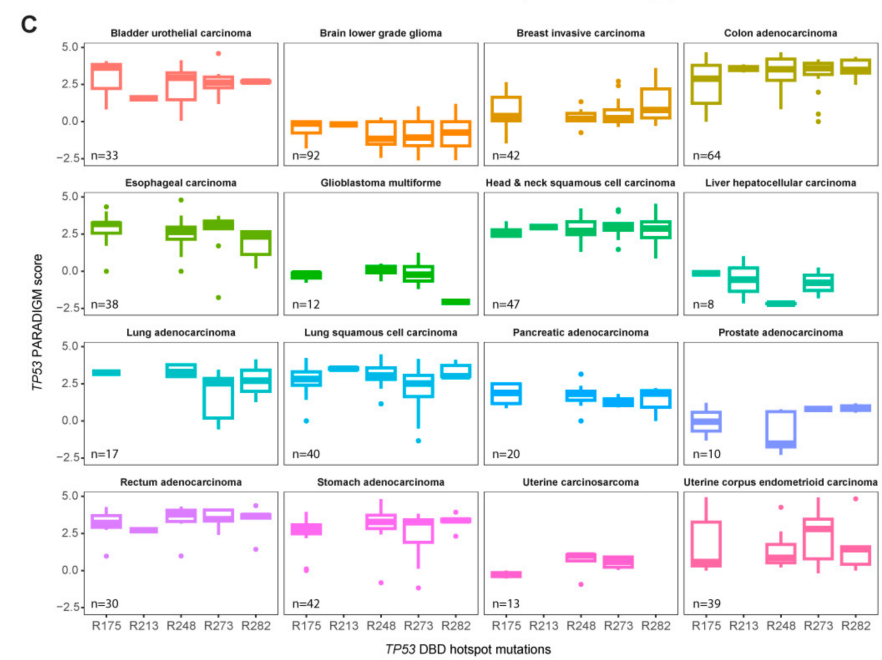
➡️ TP53을 포함하는 pathway 발현이 서로 다른 조직에서 비특이적인 변화
➡️➡️ p53 DBD 내 missense mutation은 그 자체만으로 p53의 분자적 경로를 크게 변형시키지 못함.
또한 missnese mutation은 TP53 신호 전달 경로에 예측하기 어려운 영향을 주며, TP53의 기능에도 상실과 획득을 모두 가능하게 하면서 영향을 주고있어요 😭
따라서 TP53 mutation은 영향을 받는 경로 변경에 직접적인 연관성이 없었고, p53의 기능적 손실이나 증가를 유도하는 다른 원인을 찾아야 한다는 것을 알 수 있었어요!
2️⃣ HOPS Drives Apoptosis of p53 Mutants
: HOPS는 p53 mutant의 세포 자멸을 유도한다
과거 연구에서 HOPS 부재시 apoptosis의 수준이 크게 줄어드는 것을 확인했어요! 이번 연구에서는 UBL HOPS가 p53을 세포질로 이동시키고 monomer로 p53을 안정화시켜 반감기를 연장시키고 올바른 apoptosis를 활성화시킨다는 점을 기반으로, HOPS가 정상 p53 뿐 아니라 mutp53 (mutant p53)에도 결합하여 apoptosis를 유도할 수 있는가 확인하고자해요!
이를 위해 서로 다른 hotspot에서의 돌연변이를 갖는 세포주를 선정했어요 😉
- SKBR3 (유방암's) : R175H에서 돌연변이
- MIA PaCa2 (췌장암's) : R248W에서 돌연변이
- H1975 (폐암's) : R273H에서 돌연변이
p53 mutant 갖는 세포주가 세포사멸을 겪게하는 능력을 평가하기 위해 etoposide 치료를 활용하였고, HOPS의 세포사멸 유도 능력을 이와 비교하기 위해 HOPS 과발현을 진행시켰어요!
세 가지 세포주를 empty vector, HOPS-encoding vector에 형질 감염시켰어요!
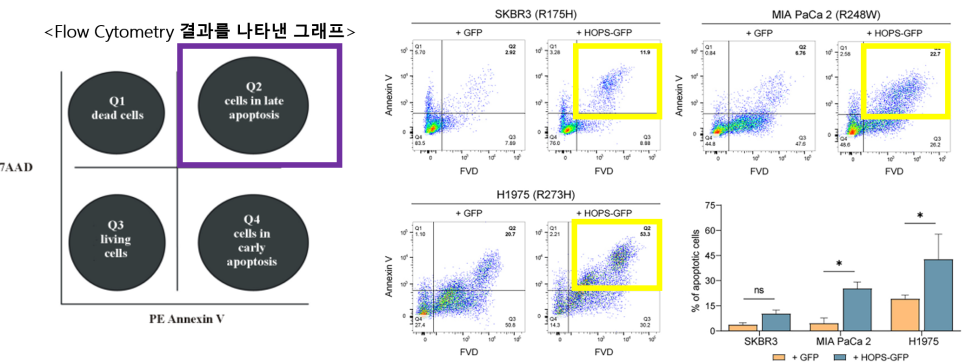
모든 세포주에서 HOPS의 과발현 샘플(+HOPS-GFP)에서 Q2, Q4 영역에서 확인되는 apoptotic cells이 empty vector에 비해 매우 크게 나타났어요!
이를 통해 HOPS의 과발현은 종양 세포주에 apoptosis를 유도할 수 있다는 것을 알았고, 세포주 모두 p53 DBD에 missense mutation 가지고 있지만 apoptotic pathway가 여전히 활성화되었다는 것을 확인할 수 있었어요!
➡️ HOPS의 과발현은 p53 돌연변이 상태에 상관없이 세포 사멸을 유도!
3️⃣ HOPS Binds TP53 after Stress stimuli
: 스트레스 자극 후 HOPS는 TP53 mutant에 결합한다.
이번에는 HOPS가 스트레스 자극을 받은 조건에서 mutp53에 결합하고 안정화시킬 수 있는지 확인하고자 실험을 진행했어요!
etoposide 처리로 mutp53을 갖는 세포주들에 자극을 주고, 면역공동침강 (Co-IP) 요법을 사용해 그 결과를 확인했어요!
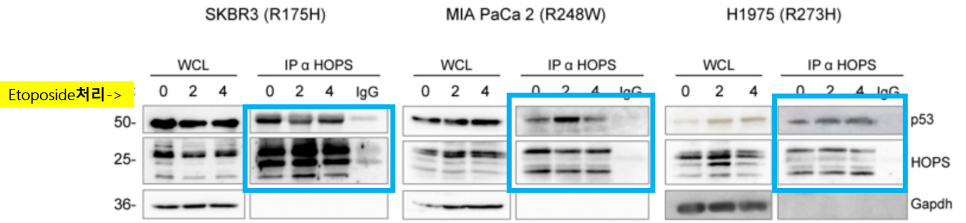
etoposide를 모든 세포주들에 각각 0시간, 2시간, 4시간 동안 처리해 세포 스트레스 유도를 유도했어요! (0시간 : 스트레스x) 파란색 박스를 확인했을 때, etoposide 처리를 받지않거나 (0h), 처리를 받은 (2h, 4h) 모든 세포주들에 대해 HOPS는 mutp53과 결합하여 westernblot의 gel에 나타난 것을 알 수 있어요!
➡️ 세포 스트레스에 상관없이 HOPS는 mutp53과 결합.
4️⃣ HOPS Supports Apoptotic Response in TP53 Mutants
: HOPS는 TP53 돌연변이체 내 세포사멸 반응 촉진
이전 실험을 통해 HOPS가 mutp53에 결합할 수 있음을 확인했기 때문에, 이번에는 HOPS가 mutp53 oligomer을 세포질에 안정화시켜 세포 사멸을 유도하거나 종양 발달을 촉진하는 효과를 보이는지 확인해보았어요!
(1) p53 인산화 비교
SKBR3, MIA PaCa2, H1975 세포주에 HOPS를 형질감염시킨 뒤 인산화된 p53과 비인산화된 p53의 수준을 비교했어요!
- 비인산화된 p53 : 불안정하고 비활성화된 상태.
- 인산화된 p53 (ser-15, active form) : 안정화되고 활성화되어 세포 주기의 정지, DNA 수선, 세포사멸 기능 수행
➡️ 인산화된 p53은 세포 사멸을 유도해 암 발생을 억제할 수 있음을 의미
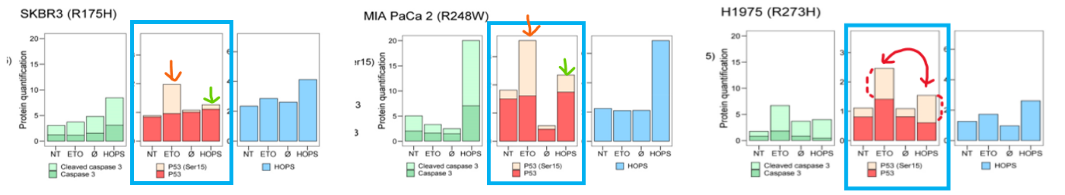
파란 박스 안 세포주 별 각각 2, 4번째 막대 그래프의 연주황색 영역에 집중해주세요! (x축의 ETO : etoposide 처리, HOPS: HOPS 과발현 샘플)
- SKBR3와 MIA PaCa2 세포주 : etoposide 처리시 ser15 인산화 p53 수준 증가 but HOPS 과발현시엔 x
- H1975 세포주 : HOPS 과발현시 etoposide 처리시와 유사한 수준의 p-p53 관찰됨
➡️ H1975 세포주에서 HOPS는 etoposide 처럼 p53 인산화를 통해 종양을 억제할 수 있음을 알 수 있어요!
(2) Cleaved caspase 3 수치 변화 비교
- Cleaved caspase 3는 apoptosis가 유발되었다는 것을 나타내는 지표에요!
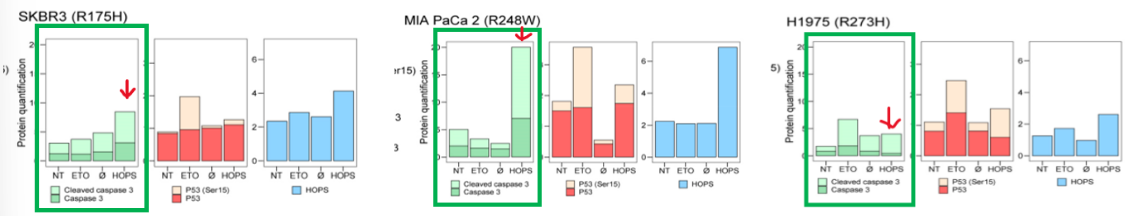
초록색 박스에서 각 세포주별로 4번째 막대그래프의 연두색 영역에 집중해서 cleaved caspase 3 수치 변화를 확인해보면, 모든 세포주에서 HOPS 과발현시 Cleaved-Caspase3 수준이 높게 나타난 것을 확인할 수 있어요!
➡️ HOPS가 돌연변이 p53 유무와 상관없이 apoptosis를 유도할 수 있음!
5️⃣ High Expression Levels of HOPS Positively Correlate with Apoptotic Genes in TCGA Patient Cohort
: 높은 수준의 HOPS 발현은 세포사멸 유전자들과 양의 상관관계를 가진다.
📍 NOXA1 : NADPH 산화효소 활성화제1. ROS를 도입해 세포사멸 활성화 유도
세포사멸 촉진 유전자 BAX, BBC3, NOXA1의 발현이 HOPS 발현 수준에 따라 어떻게 관련되는지 확인해보고자 실험이 진행되었어요!
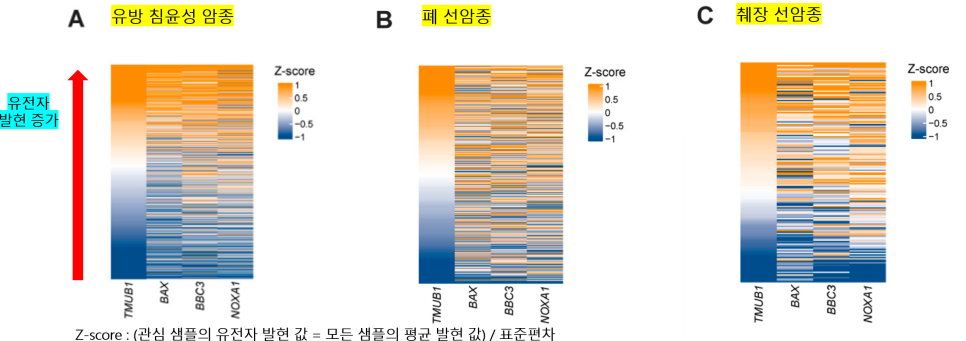
z-score이 위로 증가할수록 각 유전자의 발현이 증가한다고 할 수 있어요!
TMUB1 (=HOPS)의 발현이 증가함에 따라 BAX, BBC3, NOXA1 유전자들의 발현이 대체적으로 증가함을 확인할 수 있어요!
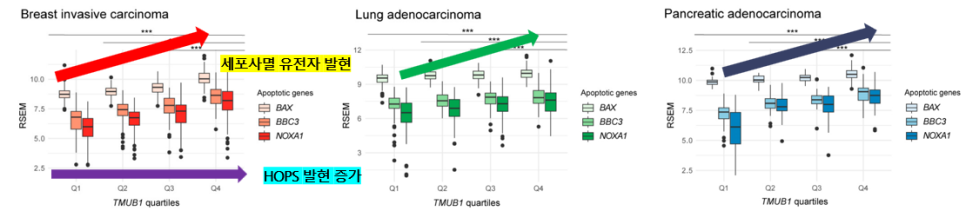
이번에는 HOPS 발현 수준에 따라 TCGA 환자를 사분위수로 나누어 분석해보았는데, 사분위수는 데이터를 네 개의 동일한 부분으로 나눈 것을 의미해요! 각 부분은 데이터를 각 25%씩 포함하게되는거죠!
(Q1 : 하위 25%, Q2 : 하위 25~50%, Q3 : 하위 50~75%, Q4 : 상위 25%)
Q1,2,3에 비해 HOPS의 가장 높은 발현을 갖는 Q4에서 세포 사멸 촉진 유전자들의 발현이 유의미하게 증가함.
➡️ HOPS는 세포사멸 촉진 유전자들과 유의한 상관관계를 가지며, 이는 HOPS/TMUB1 발현이 높은 환자에게서 세포 사멸이 활성화될 것이라는 것을 의미!
아 참! 이 실험에서 참여한 TCGA 환자들에는 p53 돌연변이를 갖거나 갖지 않는 환자가 모두 포함되어있었어요!
➡️ 따라서 HOPS와 Apoptosis 촉진 유전자의 양의 상관관게는 p53의 상태에 영향을 받지 않는다는 중요한 사실 또한 알 수 있었어요!
* p53의 상태 : wild type, mutated, absent 모두 가능
📑 이번 연구 결과 정리 및 시사점
☑️ 기존 지식
- p53은 종양 억제제로서 50% 이상의 암에서 TP53 돌연변이 有
- 암 진행 조절에 가장 중요하기에, 유전적 안정성 유지하고 암 발생을 방지하는 데에 p53가 중요한 역할을 수행
☑️ 이번 연구 결과
1. p53의 DBD에서의 arginine에서 나타나는 가장 빈번한 돌연변이 위치 ‘핫스팟’ 세 부분에서 나타나는 돌연변이를 갖는 세가지의 종양을 통해 p53 missense mutation 분석 결과
➡️ p53 pathway를 과하게/약하게 활성화 시키는 것은 missense mutation (x), UBL 등 다른 요인 (o)
2. HOPS 과발현은 SKBR3(유방암), MIA PaCa2(췌장암), H1975(폐암)에 대해 높은 수준으로 세포사멸을 자극함.
➡️ HOPS가 세포자멸사 경로에서 잠재적 역할 할 수 있음을 시사
3. HOPS는 p53에 결합해, 분해되는 것으로부터 보호하고 반감기를 늘림. 이를 기반으로 HOPS가 p53 돌연변이체에도 결합하고 보호할 수 있는지 실험
➡️ 가능
4. HOPS가 mutp53과 면역침전 되는 것을 확인함으로써 p53 기능에 영향을 줄 수 있음을 확인.
➡️ HOPS는 p53 기능을 강화시키거나 약화시킬 수 있고 세포 생존 또는 종양 성장에 영향 줄 수 있음.
5. MYC(암 유전자)와 TP63(p53의 공동 활성화 인자)에 대한 HOPS 유전자 발현 : 세가지 세포주에서 속도는 다르지만 서로 다른 활성화 경로를 따르며 apoptosis 일어남.
6. BAX, BBC3, NOXA1 세포사멸 촉진 유전자에 대해 HOPS 발현이 상관관계를 가짐. 이와 동시에, 과발현시 세포자멸사 경로를 활성화. 또한 p53 돌연변이 유무에 상관없이 이러한 상관관계가 나타남.
➡️ 종양 억제 유전자 p53의 단일 돌연변이는 해당 경로의 deregulation을 나타내기에 충분x, 필요x
위와 같은 6가지로 분석된 결과들을 바탕으로, TP53 돌연변이, HOPS/TMUB1, 세포자멸사 경로간의 복잡한 상호작용을 확인했다는 점에서 암 치료를 위한 잠재적 접근법에 대한 새로운 사실을 알아볼 수 있는 기회였어요!
🖊️ 작성자 : 하예지 (hyj9095@naver.com)
🌟밝히자, 바이오 세상💡
💯 다음 글에서 만나요!


댓글
의견을 남겨주세요