MSD의 만성기침치료제(UCC/RCC)인 gefapixant가 통계적 유의성을 달성했음에도 adcom에서 1:12로 강력한 반대를 받았습니다. 심지어 FDA가 먼저 이슈제기를 한 만큼, 사실상 승인거절이 예상됩니다.
2가지 불안요소
FDA/adcom의 반대에는 2개의 큰 문제가 있었습니다.
1. 통계적 유의성은 확보했으나, 효과크기(effect size)가 너무 작았습니다.
1차 평가지표는 24주차의 시간당 기침 빈도였습니다.
일단 절대값을 비교해보면 시간당 8.7 → 7.1회, 10.6 → 7.4회로 줄기는 했습니다. 그러나 약의 주요 부작용이 "미각 상실"인데, 이걸 상쇄하고 QoL을 개선할 정도로 유의미한가? 라는 질문에는 답이 되지 못했습니다.
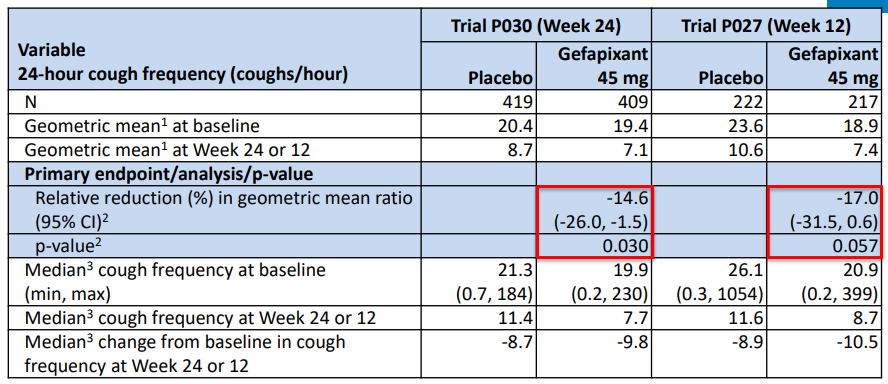
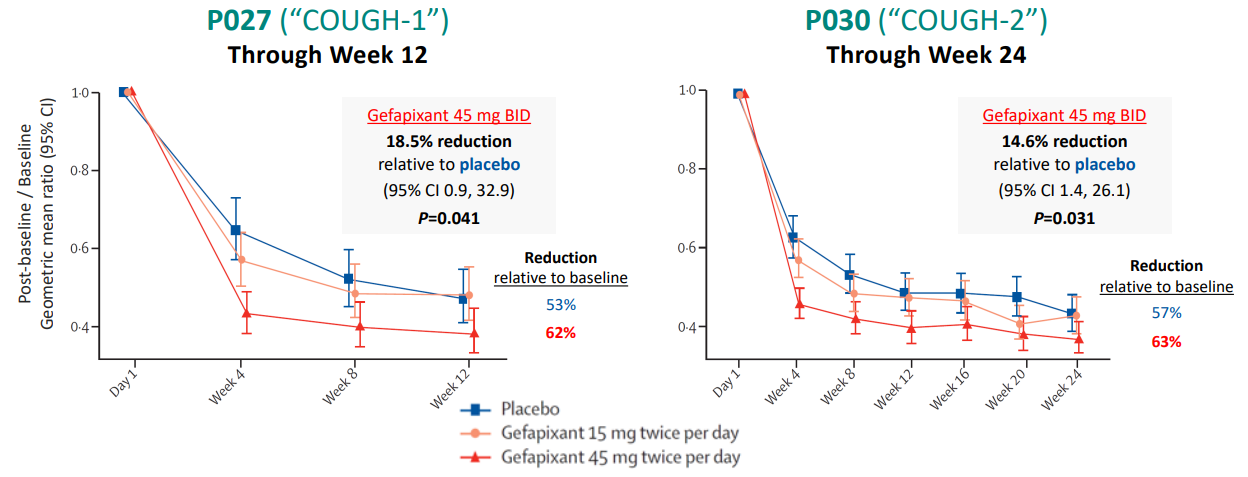
2. 더 큰 문제는, "플라시보 효과가 너무 크다"는 점입니다.
이들 만성기침환자들은 치료제가 없는 상태인데, 플라시보를 먹은 환자들에게서도 50%이상의 극적인 감소효과가 보였습니다. 이로 인해 약의 효과가 진짜 있었을까?하는 의문이 제기된 것이죠.
2.1 여기서 파생된 질문이, 기침을 어떻게 측정했는가? 하는 점이 생기게 됩니다.
이 임상에서는 FDA 인증을 받은 VitaloJAK이라는 의료기기를 사용했습니다. 그런데, 이 의료기기는 위쪽 흉골에 전극을 붙이고, 모니터기계를 허리춤에 차고 다녀야 하는데요.

의료기기를 하루종일 메고다니는것, 그리고 임상시험에 참여했다는 심리적 기제가 플라시보 효과로 작용하지 않았나 추정되는 것이죠. 기침을 덜하게 된 원인이었을 수 있습니다.
3. 또, 몇몇 위원은 미각상실이라는 부작용이 "potential unblinding"을 유발했을 것으로도 추정했습니다.
즉, 내가 실제 시험약을 복용하고 있다는 사실을 어렴풋이 알 수 있었다는 점입니다. 위에서처럼, 안 그래도 플라시보 효과가 커보이는데 이런 사실은 더욱 더 임상을 혼란스럽게 하는 점이 될 수 밖에 없습니다.

결국 해당 약은 FDA 승인 실패로 돌아갈 가능성이 높아졌습니다.
다만 의외로, 이 약은 유럽/일본에 이미 승인된 약입니다.
이번 결과를 보면서, 파이프라인 평가모델에 FDA 승인 확률을 왜 100%가 아닌 90-95%로 놓아야 하는지 알 수 있습니다.
레퍼런스