중국에서 개발된 면역항암제가 마침내 FDA의 승인을 받았습니다.
준시가 개발하고 코히러스가 상업화를 주도한 토리팔리맙입니다.

중국이 개발한 면역항암제
중국에서 자체 개발/판매 중인 PD-1 면역관문억제제 (Immune Checkpoint Inhibitor)는 무려 6개가 넘습니다.
- ('18) Junshi의 anti PD-1 toripalimab (토리팔리맙)
- ('18) Innovent의 anti PD-1 sintilimab (신틸리맙)
- ('19) Hengrui의 anti PD-1 camrelizumab (캄렐리주맙)
- ('19) BeiGene의 anti PD-1 tislelizumab (티스렐리주맙)
- ('21) Akeso의 anti PD-1 penpulimab (펜풀리맙)
- ('21) Harbin의 anti PD-1 zimberelimab (짐베렐리맙)
이들은 모두 중국 내에서 큰 매출과 성장세를 보이는 면역항암제입니다.
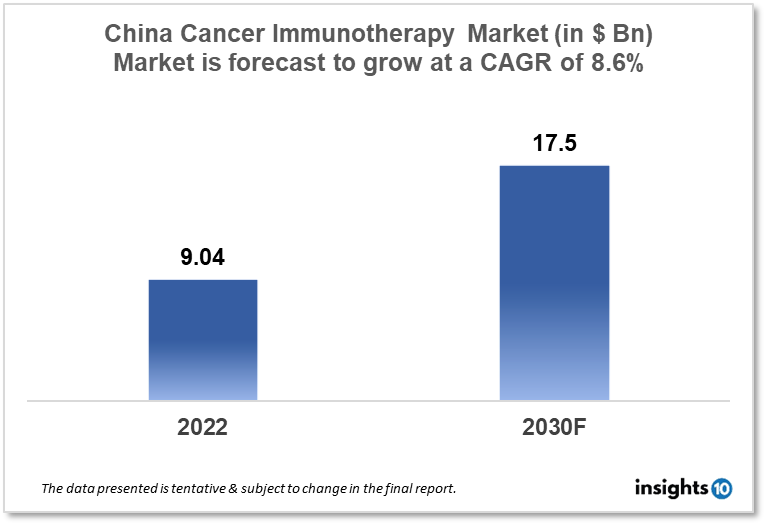
Insight10, China Cancer Immunotherapy Market Analysis
그러나 이들 중 FDA의 승인을 받은 약물은 하나도 없었습니다.
- 신틸리맙은 릴리가 권리를 사들였으나 임상디자인을 이유로 거부했고,
- 토리팔리맙은 제조시설에 대한 실사가 불가능하다는 이유로 거부,
- 또다른 중국회사인 허치메드의 수루파티닙 역시 임상디자인을 이유로 거부,
- 티스렐리주맙의 경우 제조시설 실사 불가를 이유로 심사 무기한 연기
등이 발생했습니다. 비싸게 거래된 중국산 면역항암제들이, 대부분 고배를 마셨습니다.
그리고 FDA에서 승인을 못받은 약물은 중국 외 다른 국가에서도 섣불리 쓰지 않는 경향이 있습니다. 결국 중국 내수용으로만 사용되어 왔죠.
FDA의 합리적인(?) 허가 거절
FDA도 나름(?) 합리적인 이유를 들어서 거절을 해왔는데,
- ICH E17에 언급되는 다지역 임상시험 표준이 제대로 수행되지 않았음
- (NSCLC의 경우) 표준치료가 키트루다를 포함한 ICI인데, 중국 임상에서는 백금항암제를 대조군으로 사용함
- (NSCLC의 경우) 이미 OS에서 이점을 보이는 ICI가 많은데 PFS를 평가지표로 삼는 것은 부족
- 미국의 환자 분포를 반영하지 못했다. 미국 대비 참여자가 너무 젊고, 남성이 많으며, 아시아인에 국한되어 있음
- FDA의 IND를 받지 않았고, 중국 내 자체 윤리위원회 허가만으로는 임상연구의 윤리성이 보장되지 않음 (informed consent 절차에 대한 이슈 제기됨)
- 중국 내 제조시설에 대해 (외교적 이슈 포함...?) 코로나로 인해 현장 실사 불가
등이 있었습니다.

대체로 임상시험을 새로 해야하는 이슈들이라 결국 몇몇회사들이 FDA 승인을 포기하기 이릅니다.
- 릴리가 신틸리맙 권리를 작년 10월에 반환했고,
- 노바티스가 티스렐리주맙의 권리를 올해 9월에 반환하기에 이릅니다.
토리팔리맙의 끈기
하지만 코히러스와 토리팔리맙은 조금 달랐습니다.

임상적인 문제는 희귀암종인 비인두암을 택함으로써 극복할 수 있겠다는 자신감을 확인합니다.
여기에 더해, 미국인을 추가하지는 못하더라도 싱가포르/대만 환자를 추가하면서 다지역 임상시험에 대한 이슈를 극복합니다.
- 비인두암을 선택한 것은 코히러스만의 선택은 아니었습니다. 다만 비인두암은 환자가 적고, 면역항암제들이 효과가 잘 없어 어려운 임상으로 알려져 있었습니다.
결국 JUPITER-02(NCT03581786) 임상에서 성공적인 결과를 얻었고, FDA에 허가신청을 냅니다.
처음에는 제조시설 관련 이슈로 거절당했지만, 제조시설에 대한 실사는 기다려서라도 중국 내 실사를 받겠다는 입장을 취합니다. FDA도 이 끈기에 손을 들었는지, 마침내 허가를 내 준것이죠.

이번 승인은 중국에서 제조한 면역항암제가 FDA의 승인을 받은 첫 사례이며,
향후 중국 물질들의 FDA 승인을 위한 가이드가 될 것으로 예상됩니다.
현재 코히러스의 전략을 요약하면 4가지 정도로 볼 수 있습니다.
- 미충족수요가 확실하면, 유연성을 발휘해준다. (비인두암은 표적치료제가 없는 상황)
- 다지역임상을 하면 좋지만, 안된다면 최소 아시아권에서라도 해라 (싱가포르, 대만을 포함한 것으로도 규제 유연성이 발휘됨)
- 제조공장의 위치는 큰 문제가 아닐 수 있다. 실사만 가능하면 된다.
- "미국 내" 표준치료와 임상디자인을 맞춰라. 1번이 유리한 또다른 이유.
이번 결정으로 FDA의 스탠스가 변화할지,
아니면 예외적인 결정으로 남을지는 향후 1-2년을 더 지켜보면 좋을 것 같습니다.
참고자료
코히러스의 승인공시
JUPITER-02 임상시험의 interim result(ASCO), final result, final result2(ASCO)