최초의 CRISPR 치료제에 대한 자문위원회가 열립니다.
- 바로 CRISPR Tx와 Vertex가 개발한 exa-cel입니다.
- CRISPR/Cas-9, 즉 유전자 편집 기술을 이용해서 겸상적혈구빈혈증이라 불리는 질환을 치료하는 치료제입니다.
- 유전자 편집 치료제로는 최초의 허가 신청이라 많은 주목을 받고 있습니다.

FDA가 이번 미팅을 위한 사전 질의 자료를 공개했는데요 (링크),
흥미롭게도 FDA의 요청사항은 하나였습니다.
"회사가 제출한 off-target effect analysis가 적절한가?"
즉, 예상되는 부작용이 없다고 진짜 말할수 있는가...하는 점이죠.
- 크리스퍼라는 기술은 유전자 서열(부위)를 인식해서 자르는 기술이기 때문에, 제대로된 부위에 가서 잘랐는지 (on-target effect),
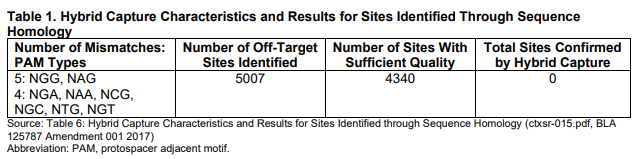
- 그리고 인체 내 30억개나 되는 서열 중에 해당 서열만 자르고 다른 부분은 안잘랐는지가 매우 중요합니다 (off-target effect).
회사는 크게 in-silico와 cellular, biochemical로 검증을 했고, FDA는 여기에 의문을 제기했습니다.
내용을 보자면,
Q1. In-silico로 검증하기에는 불명확한 분석이 많다.
- 레퍼런스로 사용한 데이터가, 실제 환자가 가진 변이데이터와는 다릅니다.
- 따라서, 정상인에게는 부작용 서열이 없었더라도, 환자에게는 있었을 수 있습니다. (확률은 낮아보입니다)
- 최근에 개발되고 있는 gRNA off-target 분석 툴을 가지고 FDA가 자체적으로 조사한 결과, 일부 툴에서는 새로운 off-target 영역을 발견했습니다.
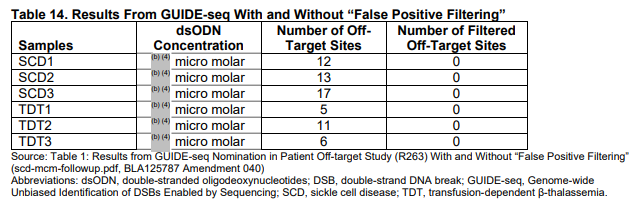
Q2. 세포실험을 통한 검증은 제한점이 많다.
- 일단 N수가 너무 적었습니다. 사실상 SCD 환자 샘플은 3개였고, 건강인 3개 + TDT 환자 샘플 3개를 포함해도 총 9개 샘플에 대한 분석만이 진행되었습니다.
- 또한 진행된 어세이가 세포 유형별 특이성 및 DNA 복구 기전과 같은 복잡성을 반영하지 못했습니다.
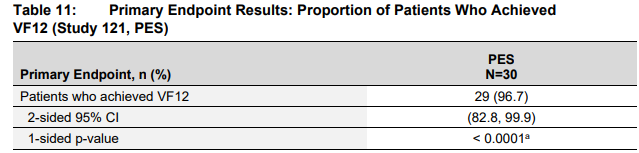
다만, 깊게 파고 들어가보면 회사는 할만큼 한 것으로 보이기는 합니다.
- 희귀질환 환자의 genomics DB나 샘플이 제한적일뿐더러,
- 이 치료제가 가져다 주는 이점과 비교하면 사소한 이슈이기 때문이죠.
- 또한 엑사셀은 임상 데이터로도 큰 문제가 없음을 현재까지 충분히 소명하고 있는 상황입니다.
결국 이번 문제제기는 치료제가 아닌, CRISPR라는 기술 자체에 대한 의구심에 가깝습니다.
치료제의 효능과 제조과정에 대해서는 큰 문제를 삼지 않았죠.
사실상 환자들에게 어떤 위험이 있다고 보기보다는 기술적으로 "CRISPR에서는 이게 최선인가?"를 확인하는 과정으로 보입니다.
미팅은 미국시간 10월 31일, 최종 승인 여부는 12월 8일에 결정됩니다.