치료제가 아니라 증상 완화제를, 그것도 기존물질의 유사체만으로 FDA 승인을 받은 바모롤론의 이야기입니다.

바모롤론이 미국시간 어제 26일, FDA로부터 최종 승인을 얻었습니다.
대상 적응증은 2세 이상의 모든 DMD 환아들입니다.
DMD라면 희귀질환 중에서도 최신 모달리티로 경쟁이 치열한 시장인데,
직원도 30명 미만이고, 투자금 80만달러로 겨우 발굴한 물질이 어떻게 FDA 승인을 받는 소분자화합물이 되었을까요?
바로 치료제 이외에도 필요한 작은 미충족수요(medical unmet needs)를 잘 찾았기 때문입니다.

DMD는 근이영양증 중에서 자주 발견되는 질환의 형태지만, 치료제는 이제 막 승인이 이뤄지고 있습니다.
- ASO 치료제 및 유전자 치료제가 주로 개발 중
그래서 아직까지는 이러한 근손실 증상을 늦추기 위한 약물이 주로 처방되며, 여기에는 염증반응을 줄이는 코르티코이드(corticosteroid)를 사용하는 것이 일반적입니다.
- 정확한 작용기전은 알려지지 않았으나, 염증반응이 근육의 손실을 촉진하는 것으로 추정하고 있습니다.
- 따라서 항염 치료제가 근손실 예방 효과가 있고, 임상데이터가 이를 뒷받침하고 있습니다.
- 대표적으로는 프레드니손과 데플라자코트(일부 부작용을 개선한 유사체)가 쓰이고 있습니다.
그런데 코르티코이드의 장기복용은 익히 알려진 여러 부작용을 동반하는데요.
가장 흔하게는 체중증가, 골밀도저하, 성장지연, 백내장 등이 언급됩니다.
DMD 질환과 이런 부작용들이 겹치면 환아는 물론 보호자에게도 큰 스트레스가 됩니다.
그래서 회사는 기존 코르티코이드의 효과는 유지하면서, 부작용은 최소화 할 방법을 찾기 시작했고, '03년도에 발표된 dissociative corticosteroid라는 개념이 이에 부합할 수 있다는 사실을 확인하게 됩니다.
- 물론 장기 복용에서 해당되는 내용입니다.
- 그래서 최근에는 효과를 유지하는 선에서 장기복용보다는 단기 간헐적 복용이 더 권장되기도 합니다.
코르티코이드는 세포막 수용체를 통과한 뒤 GR-ligand complex를 형성하고,
이 complex는 핵으로 가서
1) Trans-activator = (GRE에 간접적으로 결합하여) anti-inflammation gene을 활성화
2) Trans-repressor = NF-κB (master inflammatory regulator) binding elements와 결합하여 전사를 억제함
3) Cis-repressor = negative GRE에 직접적으로 결합하여 전사를 억제 = 부작용 발생
와 같은 기전을 일으키게 됩니다.
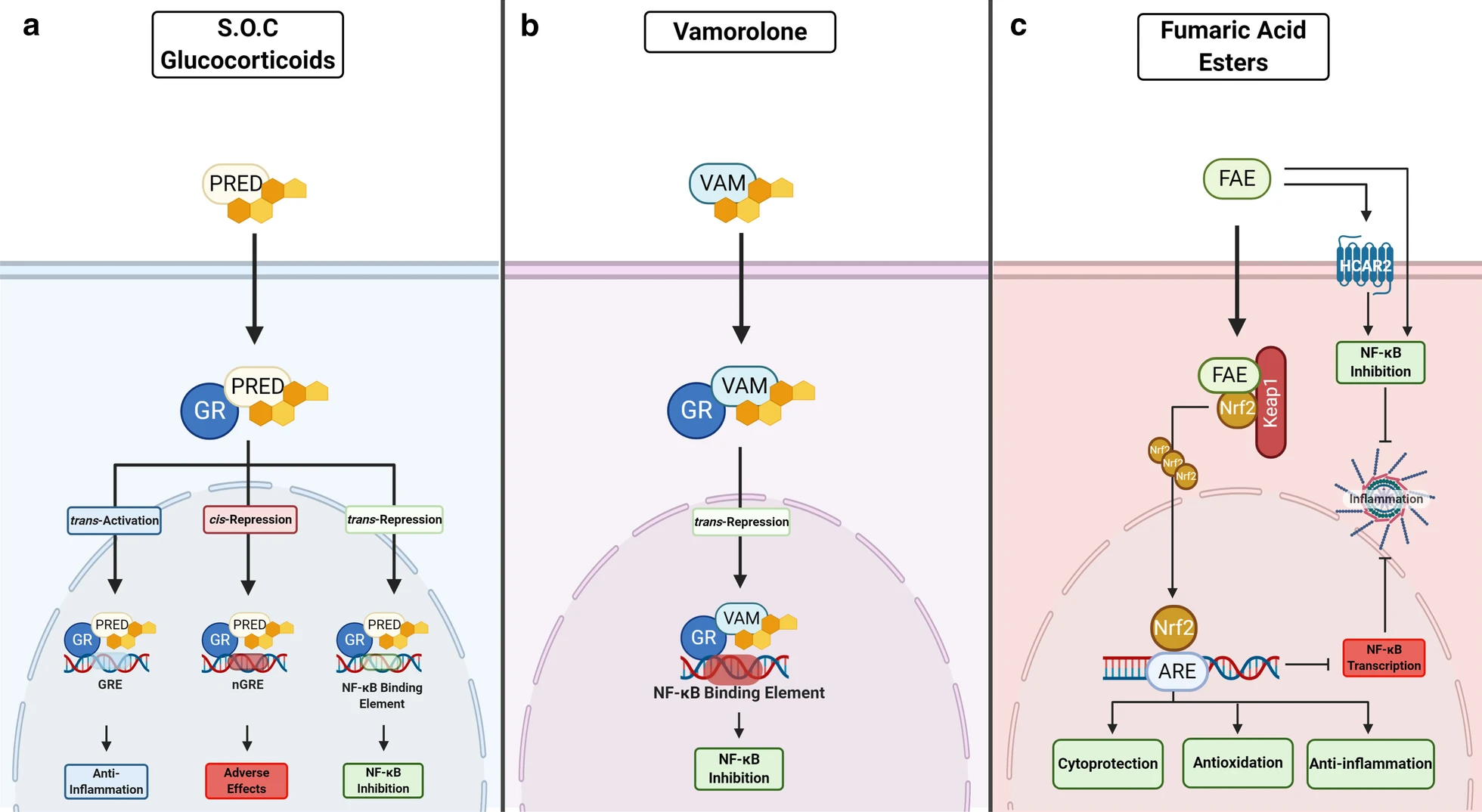
이 중 trans-activator가 알려진 부작용을 유발하는 반면, trans-repressor는 부작용보다는 염증반응 완화 효과를 유도한다는 사실이 알려집니다 ('03).
이를 토대로 "코르티코이드지만, activator로는 기능이 없고 repressor기능만 있는 물질을 찾으면 어떨까?" 라는 접근을 통해 물질을 '13년에 발견하고 VBP15라 이름 붙이게 됩니다.
이후 임상시험에서 VBP15를 1~2상에 걸쳐 시험을 했고,
확증임상인 2b상에서 placebo, prednisone을 대조군으로 검증을 하게 됩니다.
특이했던점은, safety는 placebo/prednisone군 모두를 대조한 반면,
- 골밀도와 성장에서 prednisone보다 더 나은 점을 보여주었고,
- 체중 증가 prednisone 대비 괜찮았습니다.
efficacy는 placebo군만 비교를 했고, prednisone군은 비교대상에서 제외한 것입니다.
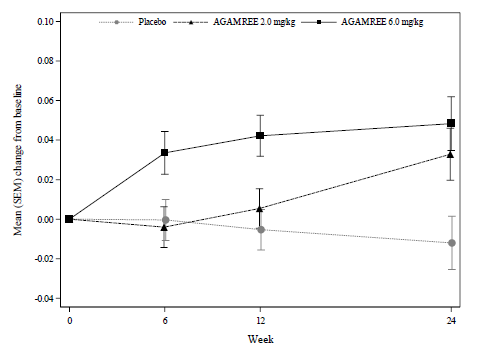
추정컨대, 특정 기전이 사라지는 만큼 약의 potency가 그만큼 떨어졌을 것으로 생각되고, 실제 efficacy가 prednisone보다 non-inferior하지 않을 수도 있다는 가정이 있었던 것으로 보입니다.
이처럼 임상 디자인도 영리하게해서, 효과와 부작용을 비교적 쉽게 검증할 수 있었습니다.
아래 그림을 보면 알 수 있듯이, 회사가 만든 약은 새로운 구조와 물질이 아닙니다. (발견이 쉽다는 얘기는 아니지만, 소규모회사가 충분히 시도해볼만한 구조적 변화였을 것으로 생각합니다)
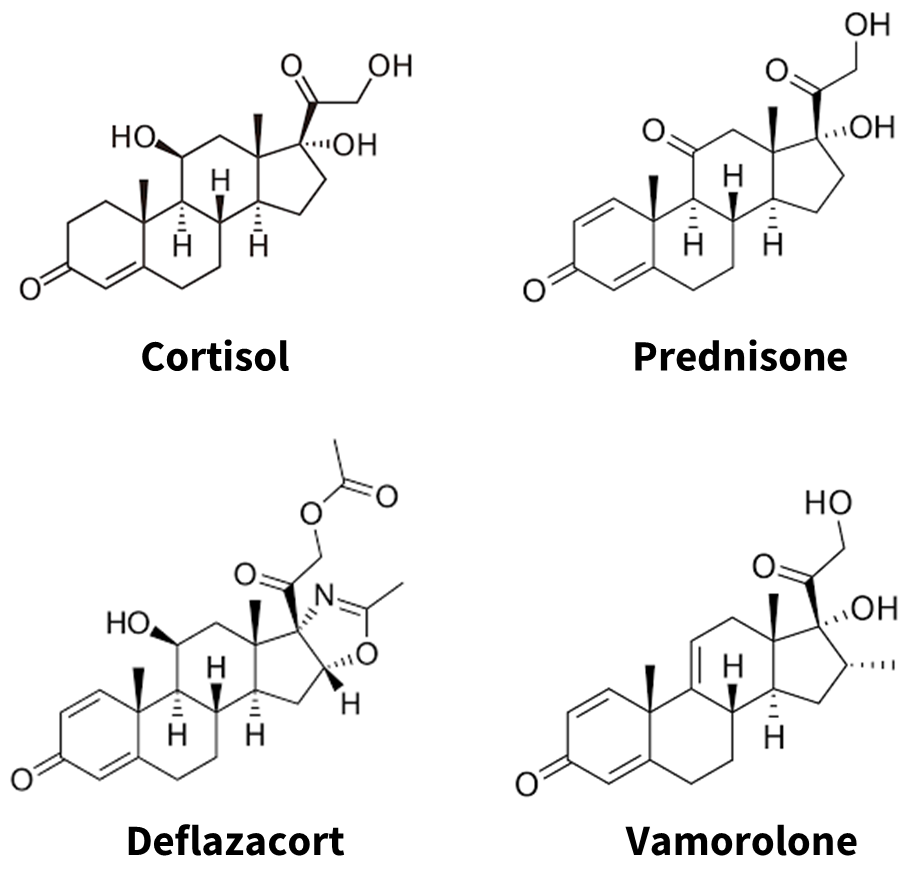
결국 '03년도에 발표된 논문의 dissociative corticosteroid라는 컨셉을 가지고, DMD에서의 unmet needs에 적용할 수 있을 것이라 판단한 것이었습니다.
특히 unmet needs가 꼭 치료제가 아니라 증상완화제의 개선에도 있다는 점을 다시금 보여줍니다.
Deal history
1. 이 물질은 reveragen에서 처음 만들고,
- 현 직원이 30명이 안되는 것으로 추정, 개발당시 펀딩 80만 달러
2. Santhera에서 권리를 확보했으며, ('20년 9월)
- Reveragen은 임상개발비용 $7M를 보장받았으며,
- 주주였던 Idorsia는 FDA 승인시 $60M를 받고, $100M 매출 시 $5M 추가 금액을 받게 됩니다.
3. 결국 카탈리스트에서 판매 라이선스를 독점확보 하게 되었습니다. (23년 7월)