입센이 마음고생을 많이한 팔로바로틴(palovarotene)이 마침내 성인 및 소아 진행성 섬유형성증(Fibrodysplasia ossificans progressiva, FOP)대상으로 승인을 획득했습니다.

FOP는 기존 골격 외 다른 부위에 뼈가 형성되고 축적되는 극희귀 유전질환입니다. 미국에는 약 400-600여명, 전세계적으로도 수천명에 불과할 것으로 추정됩니다.
대부분의 환자는 자라면서 스스로 먹고 마실 수 없게되며, 30세 이후에는 대부분 휠체어를 필요로 하게 됩니다. 또한 흉곽주위에도 뼈가 형성되어 심장 및 폐기능 문제로 인해 기대수명이 40-50세로 알려져 있습니다.
팔로바로틴은 RARγ agonist로 이런 부적절한 뼈형성을 막아주는 약물입니다.
팔로바로틴, 개발부터 승인까지의 험난한 과정
이번 FDA의 승인까지 입센은 거친 과정을 거쳐왔습니다.
원래 시작은 로슈가 COPD용으로 개발하던 약물을 ('08),
캐나다의 클레멘시아가 인수, FOP로 적응증을 변경하였고 ('13),
이 회사를 입센이 인수하면서 가져오게된 약물입니다 ('19).
그러나 얼마 지나지 않아 FDA로부터 소아 대상의 임상을 중단하라는 명령이 내려옵니다 ('19년 12월).
팔로바로틴은 FOP 치료를 위해 골형성을 막아주는 약인데, 부작용으로 소아들의 성장판이 일찍 닫힌다는 문제가 제기된 것이죠.
그리고 한달 뒤 12개월 중간데이터로 무용성(futility) 분석을 한 결과, 임상효용성이 없다는 문제가 제기되어 환자투약이 멈추기도 했습니다 ('20년 1월).
사후분석결과(post-hoc analysis) 다행히도 치료가능성이 보인다는 전제로 3월에 임상은 재개되었으나, 소아를 대상으로 하는 2상은 결국 종료되었습니다.
당시 CEO도 바뀌고, 주가도 폭락하는 등 여러 악재가 겹쳤었죠.
(그 와중에 FOP에서 경쟁약물인 로슈의 가레토스맙은 긍정적인 2상 결과를 내놓아 더 위축되기도 했죠)
그럼에도 회사는 임상을 끝까지 마무리 했고,
자연/과거 연구 대조(natural history study, NHS)군과 팔로바로틴 투여군 각 100명을 비교한 3상의 결과를 발표했습니다 ('20년 8월).
그런데 여기서도 문제가 발생합니다. 사전에 정의한대로 통계분석을 했더니, 일차평가지표를 만족하지 못했습니다.
- 새로 생성되는 이소골화(heterotopic ossification HO)가 5%줄기는 헀으나 통계적으로 유의미하지 않았습니다.
그런데 NHS군과 비교를 하다보니 NHS의 데이터가 일부 편향이 있었다는 점을 알게 되었고,
새로운 통계분석법을 도입하니 1차평가지표 HO가 16% 줄어들면서 통계적으로 유의미한 결과를 도출하게됩니다.
- 또한 연간 HO 발생크기로 보았을 때 대조군 대비 54%까지 감소하는 것을 보여주었습니다.
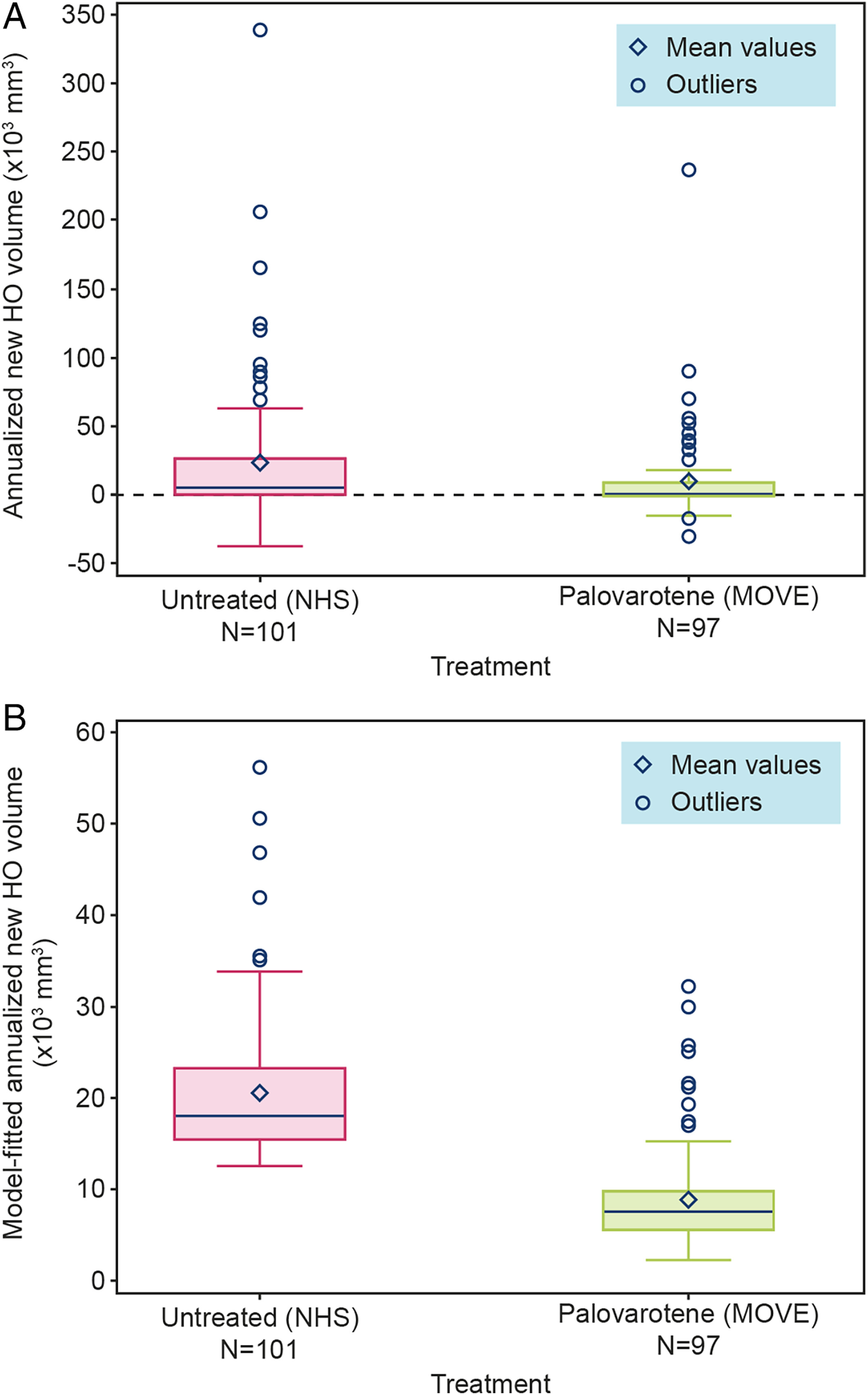
그러나 2차 및 탐색 평가지표에서 본 임상적 지표들은 유의미한 차이를 달성하지 못했습니다.
또한 앞서 FDA의 언급처럼, 아직 뼈가 자라는 어린 환자들에게는 성장판 조기 유합(premature physeal closure, PPC) 관련 부작용이 있을 수 있다는 결과가 나왔습니다.
이렇게만 보면 risk와 benefit이 혼재된 상황이기에 판단이 쉽지 않았을 것으로 추정됩니다. 그러나 1차평가지표는 달성했고, 비싼 돈을 들여 사온 약 (약 1.3조원)을 포기할 수는 없었던 것으로 보입니다.
입센은 결국 초기 SAP에 정의되지 않았지만, 효과를 보일 수 있는 새로운 분석방법을 기준으로 FDA 및 EMA에 판매승인을 위해 NDA/MAA를 제출했습니다.
이와 같이 불완전한 데이터는 결국 허가기관과의 충돌로 나타났습니다.
우선 FDA로부터는 추가 보완요구를 받아 NDA를 1차적으로 철회합니다 ('21년 8월).
그 후 데이터를 보완하여 NDA 우선 심사를 다시 제출했지만 ('22년 5월),
이번에는 CRL을 받게 됩니다. 추가적인 데이터를 더 제출하라는 요구였죠 ('22년 12월).
- 다행히도 추가 임상이 필요하지는 않았습니다.
그래도 입센은 포기하지 않고 FDA의 요구 데이터를 제출했고 ('23년 초),
Adcom미팅에서 10-4로 긍정적인 투표 결과를 받았으며 ('23년 6월),
마침내 이번에 승인까지 오게 된 것입니다 ('23년 8월).
- 그 와중에 EMA는 최종적으로 승인을 거부했습니다......
결과적으로 팔로바로틴은 최초의 FOP 치료 약물로서 시장에 진입하게 되었습니다.
- 여성 8세, 남성 10세 이상의 FOP 환자를 대상으로 예방요법으로 사용이 가능해졌고,
- 다만 경고문구(blackbox warning)로 소아 환자의 성장판 조기 유합 및 배아-태아 독성이 포함되었습니다. 따라서 임신 중에는 금기약물입니다.
표적과 약물에 대한 확신으로, 적응증과 통계분석법까지 바꿔가며,
적응증 변경과 임상보류, 허가기관의 검토 지연, 거절을 모두 이겨낸 약물로 시장에 이야기가 남지 않을까 싶습니다.
입센은 이번 승인으로 Priority Review Voucher를 획득했고,
약의 처방가격은 연간 62.4만 달러로 예상되고 있습니다.