FDA에서 다발성 골수종을 위한 이중항체, 엘렉스피오(Elrexfio, elranatamab)를 가속 승인 했습니다.

이번 승인은 다발성 골수종을 치료하는 이중항체로는 세번째이며, 체중과 무관하게 즉시 사용가능한 고정 용량 치료제라는 특징이 있습니다.
원래 다발성 골수종에서 최근 몇년간 화두는 단연 CAR-T 치료제였습니다.
- 대표적으로 BMS와 2세븐티의 아벡마(Abecma), J&J와 레전드바이오의 카빅티(Carvykti) 등이 있습니다.
하지만 CAR-T가 자가유래로 복잡한 제조 공정을 거치는 반면, 이중항체는 그러한 공정이 필요하지 않고 환자군도 더 넓은 편에 속합니다.
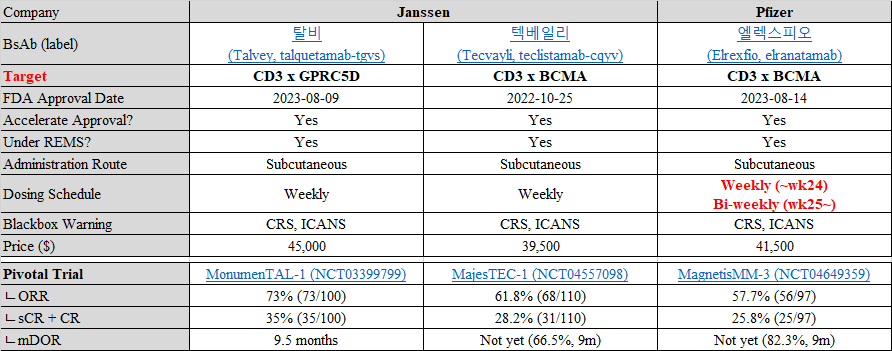
이번에 승인된 엘렉스피오는 T-cell engager 항체 치료제로서, CD3와 BCMA를 표적하고 있고,
얀센의 다른 이중항체들처럼 anti-CD38, immunomodulatory agent, proteasome inhibitor를 포함하여 최소 4가지 이상 치료를 받은 환자를 대상으로 합니다 (5th line 치료제).
또한 엘렉스피오의 라벨 역시 사이토카인 방출 증후군(CRS)과 면역 이펙터 세포 관련 신경독성 증후군(ICANS)과 같은 신경 독성에 대한 blackbox warning이 표시되어 있습니다.
이 때문에 세 약물 모두 용량별 첫 투여 후 48시간 의무 모니터링/입원 기간이 있습니다.
Pivotal trial은 MagnetisMM-3이라 불리는 2상이었습니다 (NCT04649359).
승인 데이터 기준 엘렉스피오의 전체 반응률은 57.7%로, 경쟁약물의 반응률보다는 숫자가 조금 낮습니다.
반대로, 반응기간은 경쟁약물보다 조금 더 길 것으로 보이며, 9개월 동안 반응을 유지한 환자는 82.3%였습니다.
다만 화이자의 임상결과는 cohort A, BCMA naive 환자 대상이며, BCMA 치료를 받은적이 있는 cohort B의 결과가 더 중요할 것으로 보입니다.
- 텍베일리는 BCMA naive 환자의 데이터만 통계에 포함되었으며, 탈비는 표적이 달라 이와 무관하게 효능이 측정되었습니다.
이번 승인이 가속승인인 만큼, 화이자는 2개이상의 후속 3상을 준비하고 있습니다.
- MagnetisMM-5: BCMA naive 환자를 대상으로 하는 후속 3상
- MagnetisMM-7: transplantation 이후의 유지요법으로서 효과를 확인하기 위한 3상
이로서 화이자는 얀센과, 특히 텍베일리와 정면으로 대결을 펼치게 되었습니다.
엘렉스피오의 가격은 월 약 41,500달러이며, 이는 텍베일리의 월 39,500달러보다 조금 비쌉니다 (연간 약 4.3억원 예상).
그럼에도 화이자는 투약의 편의성을 앞세워서 시장을 충분히 차지할 수 있을것으로 내다보고 있습니다.
24주까지 매주 맞는 것은 세 약물이 모두 동일하지만, 엘렉스피오는 25주차부터는 2주에 한번 맞는 것으로 전환이 가능하기 때문입니다.
결국 장기적 관점에서 내약성과 환자의 편의성이 증대될 것으로 화이자는 보고 있습니다.
반면 J&J는 상기 텍베일리-탈비 이외에도 벨케이드, 다잘렉스, 카빅티 등의 다양한 치료제를 동시 생산하는 강력한 프랜차이즈입니다.
- 선제적 치료로 쓰이는 proteasome inhibitor, anti-CD38 항체와, CAR-T 등을 각각 가지고 있죠.
화이자 경영진은 연간 매출이 40억 달러까지 증가할 것으로 예상을 밝힌 바 있습니다.