생물의 세포 수준에서 일어나는 일을 상상하는 것은 전문적인 훈련을 받은 생물학자들에게도 쉽지 않은 일입니다. 하물며 과학적 지식이 없는 비전문가들에게는 더욱 심하겠지요. 이 시리즈에서 제 나름대로 최신의 과학 발견을 쉽게 전달해드리고자 노력하고 있습니다만 사진과 짧은 글만으로는 한계가 있을 거예요.
과학적으로 풍부하면서도 이해하기 쉽게 시각화가 잘 된 영상 매체가 있으면 좋겠다는 생각을 늘 하지만 영상 제작이 워낙 품이 많이 들고 어려운 일이라 좋은 영상을 구하는 것도 쉽지만은 않습니다. 그런데 지난 2021년 2월, 미국 유타 대학교의 재닛 이와사(Janet Iwasa) 교수 연구실에서 코로나19 바이러스의 생애를 다룬 아주 훌륭한 시뮬레이션 영상을 공개했습니다. 그리고 2021년 7월 28일, 영국의 학술지 <Nature>에서 여기에 걸맞은 분석 기사를 한 편 같이 발표해서 둘을 종합하여 간단히 설명해 드리려고 합니다.
이제 '스파이크 단백질'이라는 말에는 많은 분들이 익숙해지셨을 것 같지만, 그래도 한 번 더 설명하겠습니다. 코로나바이러스의 껍질에는 돌기 모양의 단백질이 다닥다닥 붙어 있습니다. 이 단백질을 스파이크 단백질이라고 부르고, 세포의 문을 열어젖히는 열쇠 역할을 하지요. 미국 CDC에서 제작한 아래 이미지가 아마 가장 널리 사용되고 있고 한 번쯤은 보셨을 텐데, 여기서 붉은색으로 표시된 것들이 바로 스파이크 단백질이지요.
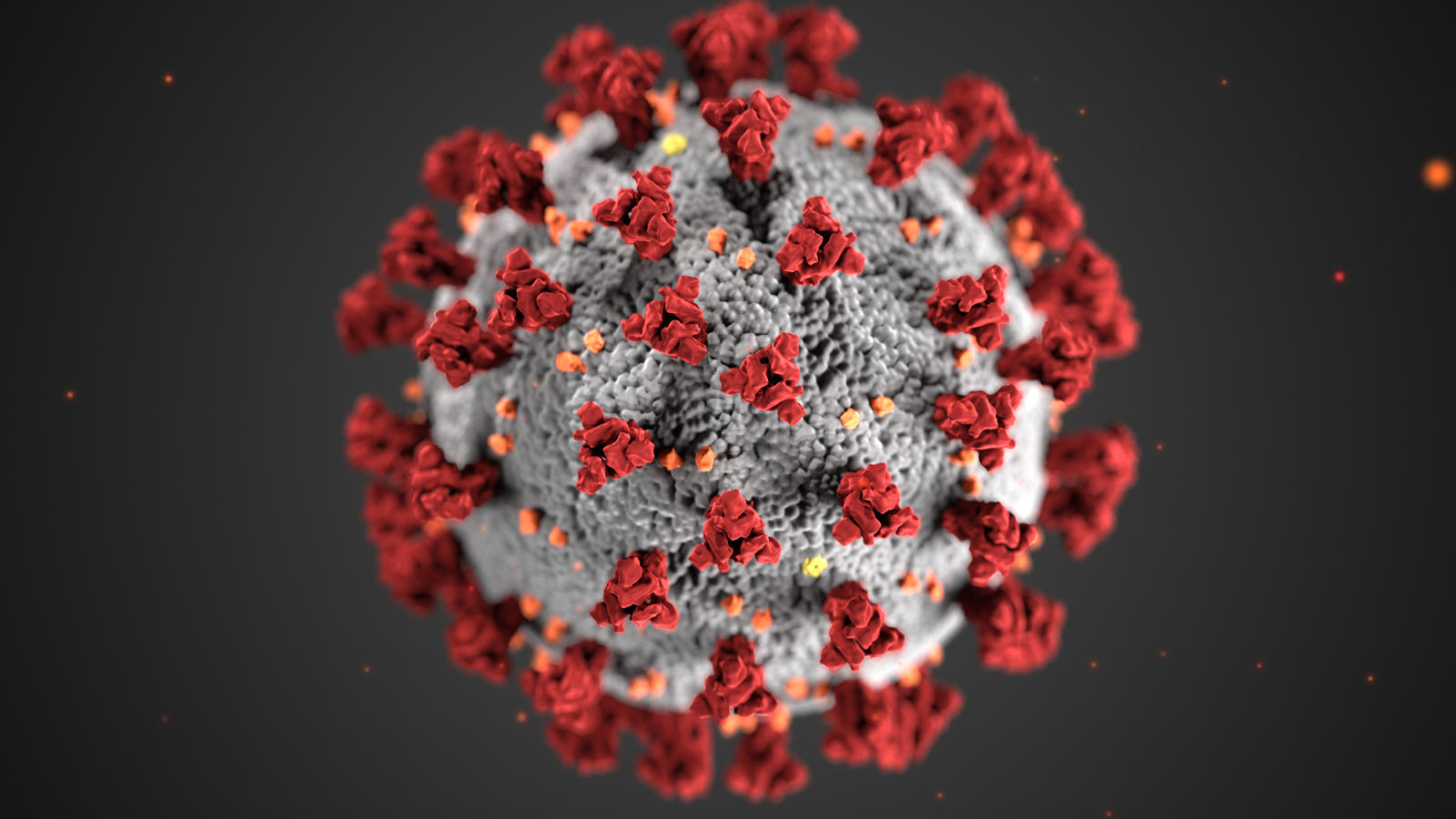
다만 코로나19 바이러스의 스파이크 단백질은 실제로는 저렇게 균일하고 깨끗하게 붙어 있지는 않고 좀 덕지덕지 무작위적으로 붙는 경향이 있습니다. 바이러스 입자 한 개에 24~40개의 스파이크 단백질이 달려 있는데, 코로나19 바이러스의 스파이크 단백질은 매우 유연해서 이리저리 접히고 흔들릴 수 있다는 특징이 있어요. 영상에서 녹색으로 표현된 스파이크 단백질들이 마구 흔들리는 게 보이실 겁니다.
코로나19 바이러스의 유연한 스파이크 단백질은 그 자체로 감염력을 키우는 요인입니다. 대부분의 바이러스가 숙주 세포에 침투하는 데 쓰는 융합단백질(fusion protein)은 잘 휘지 않고 딱딱한 구조입니다. 딱딱한 융합단백질은 어쩌다 숙주 세포의 표면에 닿았다 하더라도 융합단백질이 정확하게 '자물쇠'에 꽂히지 않으면 침입할 수 없어요. 그런데 코로나19의 스파이크 단백질처럼 이리저리 휠 수 있으면 자물쇠에 살짝 빗맞았다 하더라도 휘어 들어가면서 결합하고 세포에 침투할 수 있는 겁니다.
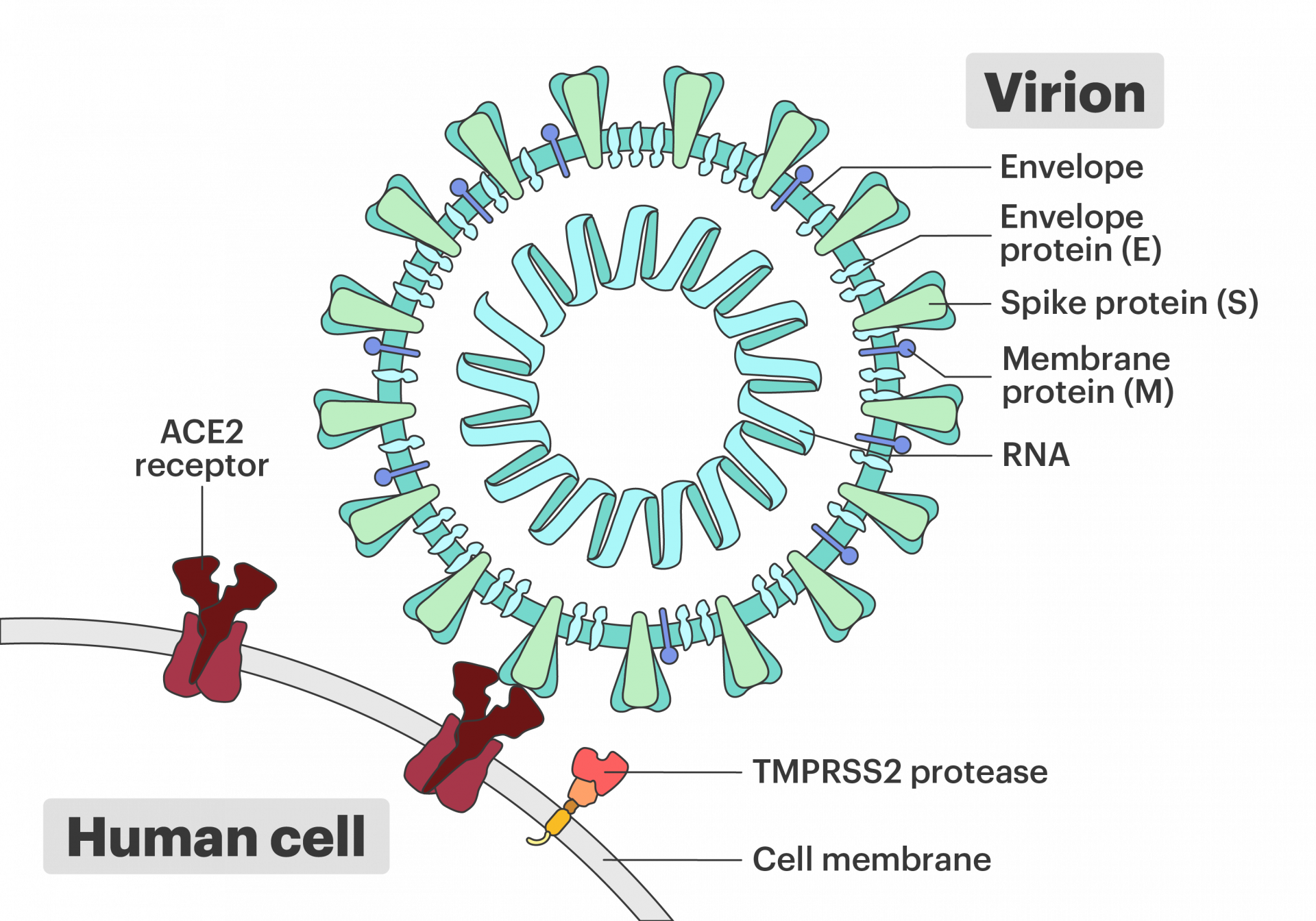
한편, 코로나19 바이러스는 교묘하게도 사람 세포의 표면에 있는 장치 두 가지를 멋대로 사용해서 우리 몸으로 들어옵니다. 첫 번째가 바로 스파이크 단백질 열쇠에 맞는 자물쇠인 ACE2 수용체입니다(에이스-투라고 읽습니다). 하지만 ACE2에 결합한 것만으로는 세포막을 열어젖힐 수 없기 때문에 한 단계가 더 필요한데요, 여기에 관여하는 게 TMPRSS2 효소(템프리스-투라고 읽습니다)입니다.
TMPRSS2가 평소에 뭘 하는 녀석인지는 아직 잘 알려져 있지 않습니다. 전립선암에 관여한다거나, 코로나19의 침투 과정에 관여한다거나 하는 나쁜 면모만 알려져 있어요. 어쨌든 코로나19 바이러스 감염 과정을 기준으로 설명하자면, TMPRSS2 효소는 ACE2 수용체에 결합한 스파이크 단백질을 싹둑 잘라 버리는 단백질 분해 효소입니다. 이렇게 해서 바이러스를 해치운다면 정말 좋겠지만, 안타깝게도 이 과정이 바로 감염의 시작입니다.
영상의 40초 지점부터 보시면, 주황색으로 표현된 TMPRSS2 효소가 다가와서 스파이크 단백질을 잘라냅니다. 그러면 스파이크 단백질에서 숨어 있던 부분이 노출되는데, 이 부분은 물과 접촉하기 싫어하는 소수성 아미노산 서열이에요. 이 녀석들이 물을 피하려고 달려드는 방향이 숙주 세포의 인지질 세포막이고, 마치 지퍼가 잠기듯 모양을 바꾸면서 바이러스와 숙주 세포를 융합시켜 버립니다. 그러면 바이러스 껍질 안에 들어 있던 바이러스의 유전물질이 인체의 세포 안으로 쏟아져 들어가는 거고요. (TMPRSS2 효소를 억제해서 감염을 치료한다는 구상이 있기는 하지만 아직 정식으로 임상을 진행하고 있지는 않습니다.)
숙주 세포에 들어간 바이러스 RNA는 이제 세포 속의 단백질 공장을 멋대로 조종해서 바이러스를 대량으로 만들어내도록 합니다. 본격적인 작업에 들어가기 전에 좀 더 악랄한 짓을 한 단계 진행하는데요, 인체의 세포는 정상적인 활동을 유지하기 위해 당연히 수많은 단백질을 만들면서 작동하고 있습니다. 숙주 세포에 침투한 바이러스가 제일 먼저 하는 일은, 자기한테 필요 없는 바이러스 생산을 모두 중단하라는 명령을 내리는 일입니다.
mRNA 백신의 원리를 설명한 글에서 소개했듯이, 생물의 세포에서는 설계도 원본인 DNA는 세포핵 속에 꼭꼭 숨겨두고 설계도의 복사본인 mRNA를 주방에 가져와서 그걸 보고 단백질을 제작합니다. 코로나19 바이러스는 숙주 세포에 침투한 다음 Nsp1이라는 바이러스 단백질을 여기저기 뿌려서 집주인의 mRNA는 전부 잘라버리고 바이러스의 RNA만 남겨두지요. 그리고 핵에서 세포질로 mRNA가 빠져나오는 모든 경로를 틀어막아서 세포가 정상적인 기능을 하지도, 외부 면역계에 경보를 보내지도 못하게 입을 틀어막은 다음 세포 안에 있는 모든 자원을 바이러스 생산에만 돌리는 겁니다.
코로나19 바이러스는 세포를 빠져나가 다음 숙주를 찾을 때마저도 숙주 세포의 자원을 써먹습니다. 퓨린이라는 효소인데요, 새로 만들어진 바이러스의 스파이크 단백질을 살짝 잘라 두는 기능을 하지요. 위에서 TMPRSS2 효소가 스파이크 단백질을 잘라 줘야 바이러스가 숙주 세포에 침투할 수 있다고 설명했지요? 퓨린 효소는 스파이크 단백질을 미리 살짝 잘라 둬서 TMPRSS2 효소가 더 쉽게 작업할 수 있도록 밑그림을 그리는 역할을 합니다. 이번 세포를 빠져나간 바이러스가 다음 세포는 좀 더 손쉽게 감염시키게 되고, 점차 걷잡을 수 없이 퍼져나가 몸을 망가뜨리게 되지요.
알파나 델타 변이 등 WHO에서 지정한 주요 변이들은 치사율을 높이지는 않지만 감염 속도를 매우 빠르게 하는 특징이 있습니다. 특히 델타 변이의 경우 퓨린 효소에 반응하는 자리에 돌연변이가 생겨서 더 쉽게 잘리는 특성이 있는데요, 숙주 세포를 빠져나가기 전에 스파이크 단백질의 75% 정도가 퓨린 효소에 의해 미리 절단된 상태로 준비된다고 하네요.
*사족. 본문에서 소개한 시뮬레이션 영상을 제작한 재닛 이와사 교수 연구실은 "The Animation Lab"이라는 이름을 달고 있습니다. 생물학 석사나 박사 학위를 갖고 있는 연구자들 중 시각화에도 재능이 있는 이들이 모여서 꾸린 독특한 팀으로, 보통의 대학 연구실과 달리 직접 연구를 수행하기보다는 수준 높은 영상이나 인포그래픽을 만드는 데 집중하는 곳이지요. 대단히 중요한 작업이지만 여기에 필요한 역량을 다 갖춘 이들이 드물어서 항상 수요에 비해 공급이 부족한 영역입니다.

![[오늘의 과학기술] 인류는 명왕성에 다시 갈 수 있을까의 썸네일 이미지](https://cdn.maily.so/mailyf79b5de607fea2eea4299003840b527d1628397327)
![[오늘의 과학기술] "델타 플러스", 아직은 걱정하지 마세요의 썸네일 이미지](https://cdn.maily.so/mailya33dcca1293ef93b7c76e2bb9fb24be01629169202)
![[오늘의 과학기술] 유전자 조작 모기 실험, 성공!의 썸네일 이미지](https://cdn.maily.so/mailyd4a07fb28d1584365959ae0ab73be0b01652018310)
![[오늘의 과학기술] 소프트 로봇의 시대가 온다의 썸네일 이미지](https://cdn.maily.so/mailyfedc598e5d20a8dd8aa6e93eb6a5e89b1644753524)
![[오늘의 과학기술] 200년 사는 볼락, 장수와 회춘의 비밀을 풀다의 썸네일 이미지](https://cdn.maily.so/mailyff6b6eba6d42d657518b715fd092f93f1652745603)
![[오늘의 과학기술] 인간처럼 리듬을 타고 노래하는 여우원숭이의 썸네일 이미지](https://cdn.maily.so/maily19e5d2ff65321ae955903ed47204eb8a1644188655)
![[오늘의 과학기술] 쓰레기장에서 귀금속을 캐낸다, 도시광산의 썸네일 이미지](https://cdn.maily.so/maily4bc6fa71f84bab0a60f2bb03b0e4945a1646963997)
![[오늘의 과학기술] 손톱만한 크기의 거대 세균 발견의 썸네일 이미지](https://cdn.maily.so/mailyacd028871c18bd1768dc047dbde045061648426506)

의견을 남겨주세요