신경섬유종증(Neurofibromatosis, NF)이란 질환을 들어보셨나요?
아마 생소하실텐데요, NF는 신경계에서 종양이 자라는 희귀 질환입니다.
2025년 2월 11일, FDA는 새로운 NF 치료제인 Mirdametinib(미르다메티닙)의 승인을 발표했어요. 상품명은 Gomekli(고메클리)입니다.

1. Mirdametinib은 어디에 쓰이는 약인가요?
Mirdametinib(상품명: Gomekli 고메클리)은 다음 조건들을 충족하는 환자들에게 사용해요:
- 2세 이상의 소아 및 성인
- 총상신경섬유종(PN)을 동반한 1형 신경섬유종증(NF1). 줄여서 NF1-PN.
- 완전 절제가 불가능한 NF1-PN
💡NF1-PN은 어떤 질환인가요?
신경섬유종증(neurofibromatosis, NF)은 단일 유전자 결함에 의해서 발생하는 대표적인 질환으로, 신경조직에 양성 종양이 발생하는 희귀질환입니다.
3500~4000명 중 1명 꼴로 발생하며, 2022년 기준 국내 20세 미만 환자는 약 2,100명으로 추산돼요. 상염색체 우성으로 유전되지만, NF 환자의 50%는 유전이 아닌 자연발생 돌연변이에 의한 것으로 가족 병력이 없어요.
NF에서 가장 흔한 유형은 신경섬유종증 제1형(neurofibromatosis type 1, NF1)입니다. 피부, 뼈, 신경계에 영향을 미치며, 특징적인 증상으로는 커피색 반점, 주근깨, 신경섬유종 등이 있어요.
* 섬유종(fibroma)이란? 우리 몸의 섬유나 결합조직으로 이루어진 양성 종양으로, 거의 모든 장기에서 발생할 수 있다.
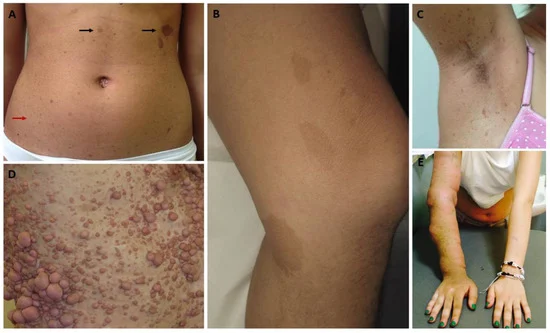
출처: Cancers (Basel). 2023;15(4):1217.
NF1 환자의 약 50%는 총상신경섬유종(plexiform neurofibroma, PN)을 동반해요. PN은 신경을 둘러싸는 조직에서 발생하는 종양입니다. 뇌와 척수를 제외한 전신의 어느 부위에서나 생길 수 있고, 큰 종양의 경우 신경을 두껍고 기형적으로 만들어 주변 뼈, 피부, 근육의 구조에 영향을 미칠 수 있어요. 대부분 양성이지만 일부 악성으로 변할 수 있어요.
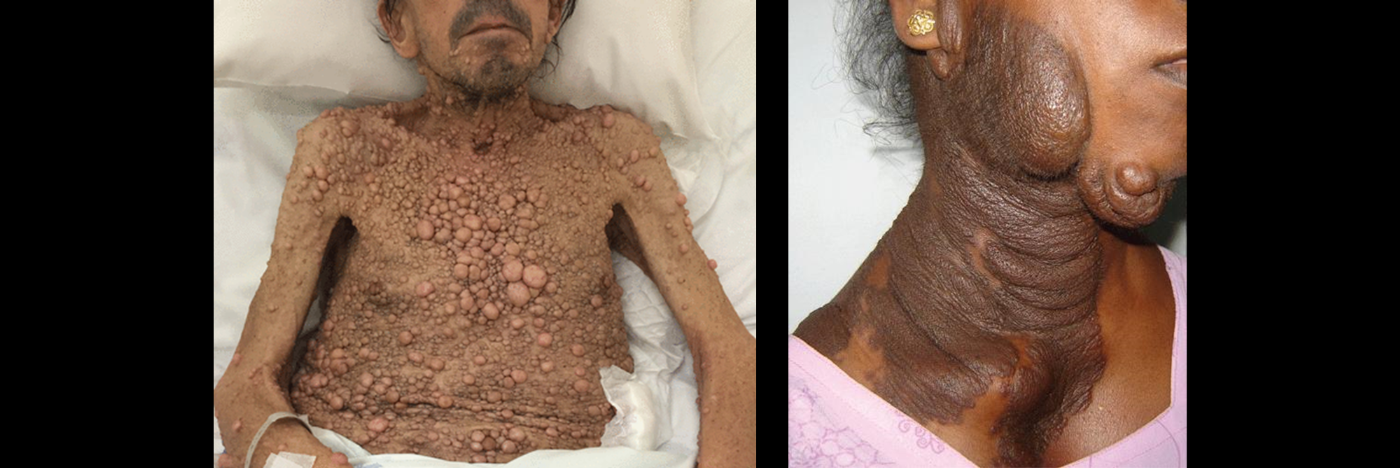
출처: (좌)BMJ Case Rep. 2016;2016:bcr2016217641.
(우)Cleveland Clinic Journal of Medicine. 2016;83(11):792.
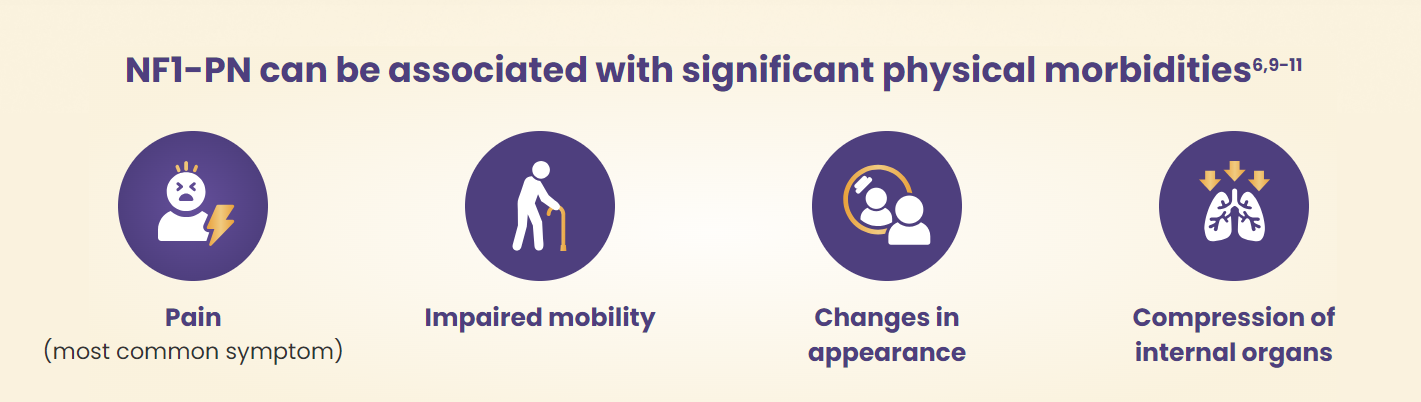
PN을 동반한 NF1(= NF1-PN) 환자는 심각한 신체적 어려움을 겪고 있어요. 모든 연령대에서 가장 힘들어하는 증상은 통증과 외모 변화입니다. 특히 통증은 아동과 청소년 환자의 삶의 질에 큰 영향을 미치고 있어요.
💡지금까지 NF1-PN은 어떻게 치료되고 있었나요?
NF1-PN의 치료는 크게 수술적 치료와 약물 치료로 나눌 수 있어요. 하지만 수술적 치료가 불가능한 경우도 많아요. 종양이 신경 주변에 깊게 자라거나 중요 장기와 가까이 있을 때는 수술로 완전히 제거하기 어렵고, 수술 후 재발 할 수도 있어요.
2020년 4월, FDA는 NF1-PN 치료제로 selumetinib(셀루메티닙, 상품명: Koselugo 코셀루고)을 승인한 바 있어요.
Selumetinib은 2021년 5월, 3세 이상의 소아 NF1-PN 환자를 대상으로 국내 허가를 받았어요. 2024년 1월에는 특정 기준을 충족하는 만 3-18세 환자에게 selumetinib 건강보험 급여 적용을 시작했어요.
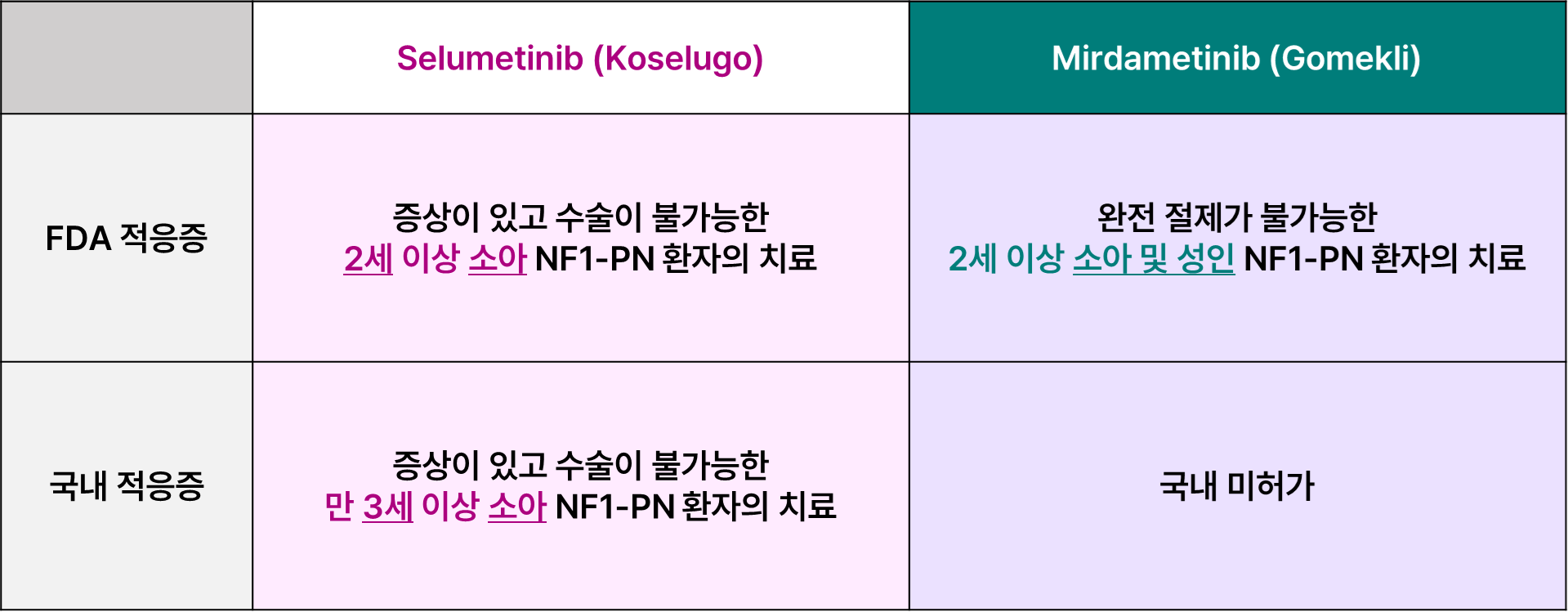
Selumetinib과 Mirdametinib의 차이점은 무엇인가요?
1. 적응증
Selumetinib은 2세 이상 소아를 대상으로 FDA 승인을 받았어요. 성인 환자에서는 조건부로 오프라벨로 사용됩니다.
반면, mirdametinib 적응증에는 2세 이상 소아뿐만 아니라 성인까지 포함돼요.
2. 복용 방법
- Selumetinib은 식사와 상관없이 매일 하루 2번 캡슐로 경구 복용해요.
- Mirdametinib은 3주 복용(하루 2번) - 1주 휴약 방식으로 식사와 상관없이 투여해요. 또한 물에 녹는 oral suspension 제형도 있어서, 캡슐을 삼키지 못하는 환자들도 복용할 수 있어요.

2. Mirdametinib은 어떻게 NF1을 치료하나요?
먼저, NF1이 어떻게 발생하는지 알아볼게요.
NF1은 17번 염색체에 위치한 NF1 유전자의 돌연변이로 발생하는 질환이에요. 이 유전자는 neurofibromin(뉴로파이브로민)이라는 종양 억제 단백질을 만드는 역할을 합니다.
정상적인 상태에서 neurofibromin은 Ras라는 단백질의 활성을 억제해서 MAPK 신호전달 경로(Ras-Raf-MEK-ERK 경로)를 적절히 조절해요. 이 경로는 세포의 성장과 분열을 제어하는 중요한 역할을 담당하죠.
하지만 NF1 유전자에 돌연변이가 생기면, neurofibromin이 정상적인 기능을 하지 못해요. 이로 인해 MAPK 신호전달 경로가 과도하게 활성화 됨에 따라, 세포가 비정상적으로 증식되고 종양이 발생하게 돼요.
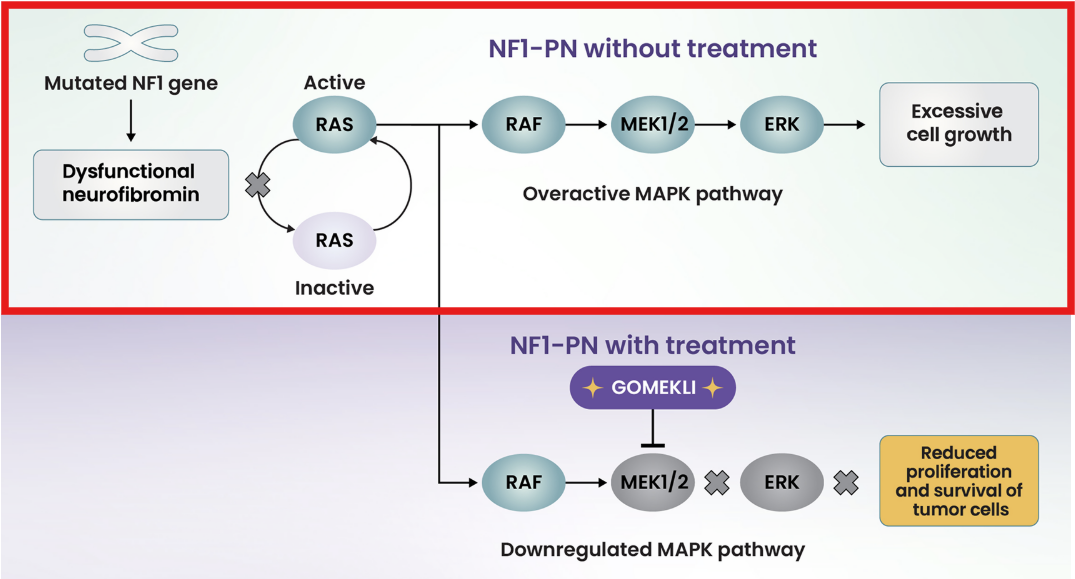
정리하자면:
- NF1 유전자 돌연변이가 발생하면, 종양을 억제하는 neurofibromin 단백질이 제 기능을 못해요.
- MAPK 신호전달 경로(Ras-Raf-MEK-ERK pathway)가 과도하게 활성화돼요.
- 비정상적인 세포 증식이 일어나요.
💡Mirdametinib의 작용기전이 궁금해요!
Mirdametinib(상품명: Gomekli)은 MAPK 신호전달 경로의 주요 매개체인 MEK1과 MEK2를 표적으로 하는 약물이에요.
ATP와 경쟁하지 않는 방식으로 작용하여, 선택적으로 MEK를 억제해요. 많은 kinase 억제제들은 ATP와 결합 부위를 두고 경쟁하는 방식으로 작용하는데, 이런 방식은 여러 kinase에 동시에 영향을 줄 수 있어 선택성이 떨어지고 부작용이 생길 가능성이 높아요.
* Kinase란? ATP에서 인산기를 다른 분자로 전달하여 그 분자의 활성을 변화시키는 효소
하지만 mirdametinib은 ATP 결합 부위가 아닌 다른 부위에 결합하기 때문에, 높은 선택성을 보인다는 장점이 있어요.
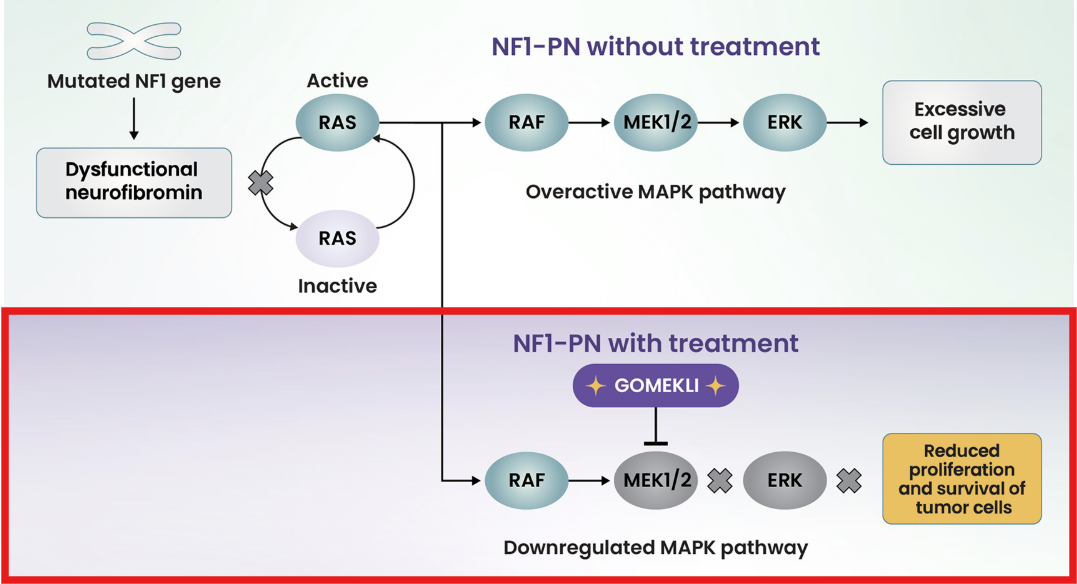
Mirdametinib이 MEK를 억제하면 하위 단계에 있는 ERK 역시 활성화되지 않아요. 활성화된 ERK는 세포 성장과 분열을 촉진하는데, 이것이 차단되면 종양 세포가 더 이상 자라지 못하게 되는 것이죠.
* MEK = Mitogen-activated protein kinase kinase
* ERK = Extracellular signal-regulated kinase
3. Mirdametinib의 개발 및 승인 과정이 궁금해요.
Mirdametinib(미르다메티닙)은 SpringWorks Therapeutics에서 출시한 NF1-PN 환자를 위한 새로운 치료 옵션이에요.
💡SpringWorks Therapeutics은 어떤 회사인가요?
SpringWorks Therapeutics는 중대한 희귀질환 치료제 및 항암제 개발이 주력인 상업 단계 바이오 제약기업이에요. 2017년에 Pfizer에서 분리되어 설립되었어요. 회사 설립 당시부터 유망한 신약 후보 물질들을 가지고 출발했고, 그중 하나가 바로 NF 치료제였어요. 2019년 9월에는 나스닥에 상장했습니다. (티커: SWTX)

Gomekli(고메클리)는 SpringWorks에서 두 번째로 상용화에 성공한 제품이에요.
그 전에는 데스모이드 종양 치료제 'nirogacestat'(상품명: Ogsiveo 오그시베오)를 출시한 이력이 있어요. 데스모이드 종양(desmoid tumor)이란, 우리 몸의 결합 조직에서 생기는 희귀한 혹 같은 것이에요. 암은 아니지만 주변 조직으로 자라나서 문제를 일으킬 수 있고, 완전히 제거하지 않으면 다시 생길 수 있어요.

또한 SpringWorks Therapeutics는 Children's Tumor Foundation과 파트너십을 맺으면서, 다른 희귀질환 치료제 연구에도 힘쓰고 있어요.
💡Mirdametinib의 승인 과정 중 특별했던 점이 있었나요?
Mirdametinib은 여러 가지 FDA 특별 프로그램의 지원을 받았어요:
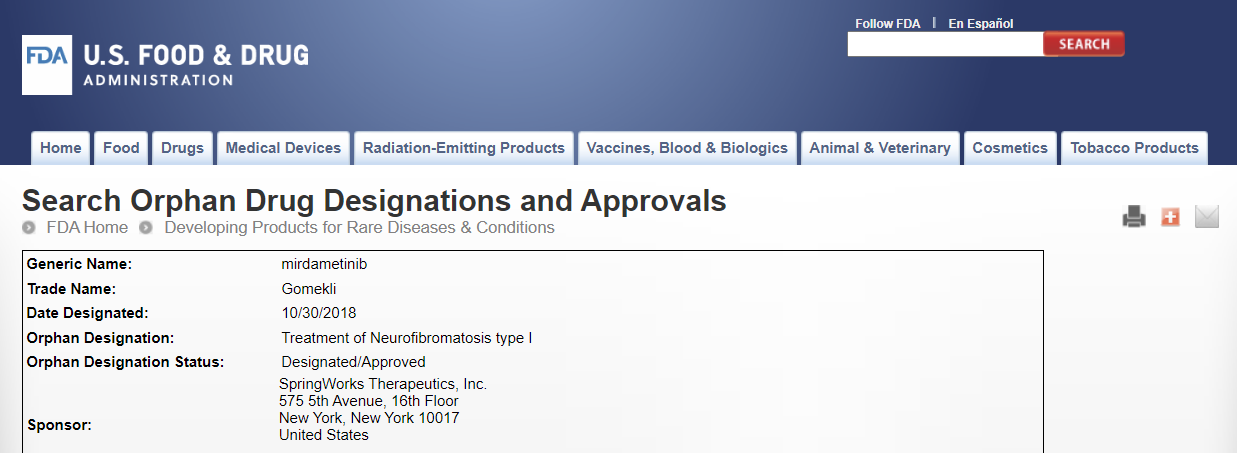
1. 2018년 10월, Orphan Drug Designation(희귀의약품 지정)을 받았어요.
Orphan Drug Designation(ODD)은 미국 내 환자 수가 20만 명 미만인 희귀질환 치료제 개발을 촉진하기 위해 부여하는 특별 지위에요. ODD는 세금 감면 및 7년 간의 시장 독점권을 제공해요.
2. 2019년 6월, Fast Track Designation(신속 심사 지정)을 획득했어요.
Fast Track은 중대하거나 생명을 위협하는 질환을 치료할 가능성이 있는 약물의 개발과 검토를 가속화하기 위한 프로그램이에요. Fast Track 지정을 받으면 FDA와 약물 개발 및 검토 과정 전반에 걸쳐 자주 소통할 수 있는 기회가 주어져요.

3. 2024년 8월, Priority Review(우선 심사) 자격을 부여 받았어요.
Priority Review는 FDA가 중대한 질환의 치료에 있어, 기존 치료법보다 상당한 개선을 보이는 약물에 부여하는 지위예요. 이 지정을 받으면 FDA의 검토 기간이 표준 심사의 10개월에서 6개월로 단축돼요.

여러 프로그램들 덕분에, mirdametinib은 개발부터 승인까지의 과정이 가속화될 수 있었어요. 결과적으로 2025년 2월에 최종 승인을 받았습니다.

Mirdametinib의 승인으로 SpringWorks는 FDA로부터 Rare Pediatric Disease Priority Review Voucher(희귀 소아질환 우선심사 바우처)를 획득했어요. 이 바우처는 FDA가 희귀 소아질환 치료제 개발을 장려하기 위해 제공하는 인센티브예요. 향후 다른 치료제 개발 시 심사 기간 단축에 활용할 수 있어요.
Priority Review Voucher(PRV)는 다른 회사에 판매할 수 있고, 최근에는 PRV가 1억 달러 이상의 가치로 거래되었어요.

Mirdametinib의 승인 과정에는 또 하나 주목할 점이 있어요.
바로 임상 3상 시험 없이, 임상 2b상 결과를 근거로 FDA 승인을 받았다는 것입니다.
💡Mirdametinib은 어떻게 임상 2b상 결과로 FDA 승인을 받을 수 있었나요?
먼저 임상시험 단계에 대해 알아볼게요.
신약 개발에서 각 임상시험 단계는 서로 다른 목적을 가지고 있어요:
[임상 1상]
건강한 지원자(또는 경우에 따라 환자) 소수를 대상으로 약물의 안전성, 내약성, 약동학을 평가하는 첫 단계예요. 주로 적절한 용량 범위를 결정해요.
[임상 2상]
소규모 환자(수십~수백 명)를 대상으로 약물의 효능과 안전성을 처음 평가하는 단계예요.
- 2a상: 개념 증명(proof-of-concept) 단계로, 약물이 질병에 효과가 있는지 초기 평가해요.
- 2b상: 용량 최적화와 효능 검증에 중점을 둔 단계로, 더 많은 환자를 대상으로 진행해요.
[임상 3상]
대규모 환자(수백~수천 명)를 대상으로 약물의 효능과 안전성을 최종 확증하는 단계로, 일반적으로 FDA 승인에 필수적이지만 특수한 경우 면제될 수 있어요.
임상 2b상 결과를 토대로 FDA 승인이 가능했던 이유
FDA의 신속 프로그램(Expedited Programs) 가이드라인을 살펴볼까요?
FDA는 중대한 질환(serious disease)을 대상으로 하는 약물의 개발과 승인 과정을 가속화하기 위한 제도적 지원을 하고 있어요.
FDA는 신경섬유종증 제1형(NF1)을 serious disease로 분류하고 있어요.
Mirdametinib은 이 중에서 Fast Track와 Priority Review 지정을 받음으로써, 승인 절차를 단축할 수 있었어요.
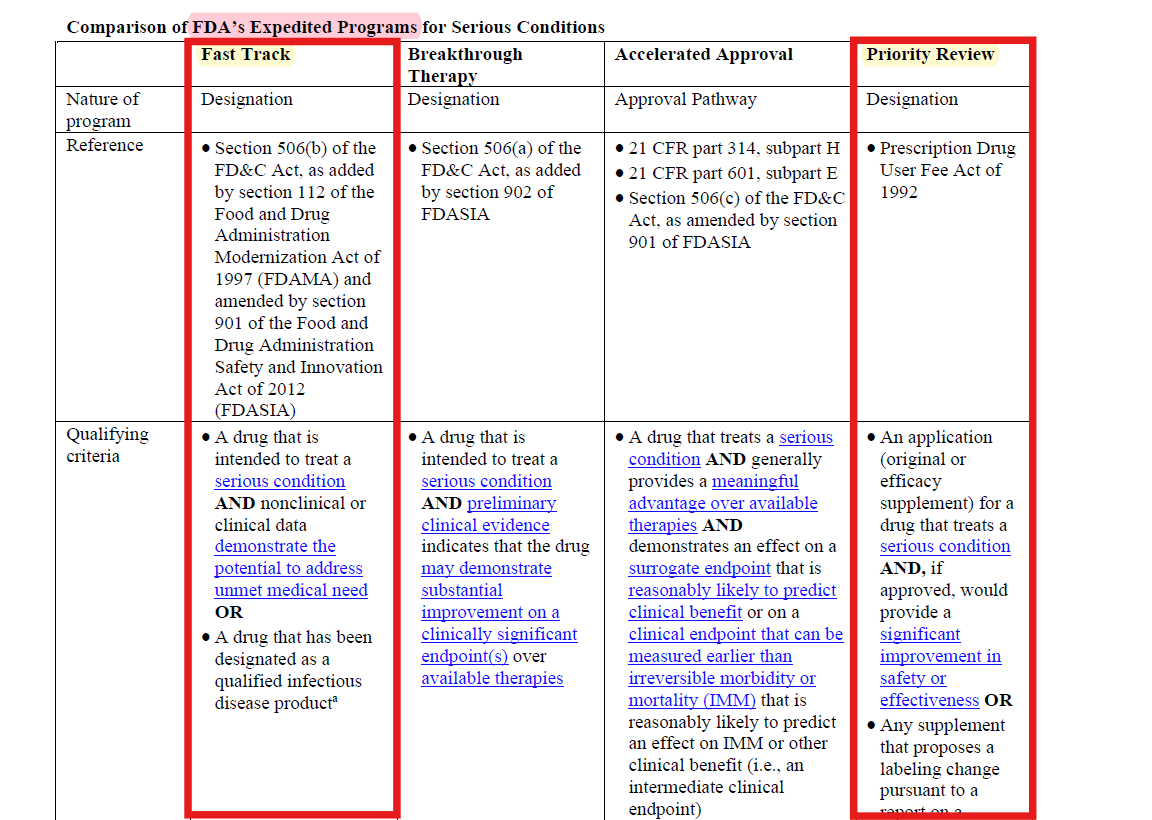
또한 해당 가이드라인에 따르면, 중대한 질환을 치료할 가능성이 있는 약물의 경우, 약물 효과의 근거를 잘 통제된 임상 2상 연구에 의존할 수 있다는 규정을 포함하고 있어요.

Mirdametinib은 임상 2b상에서 IMM 또는 다른 임상적 이점을 조기 예측할 수 있다고 여겨지는 임상 평가변수(clinical endpoint) 기준을 충족했다고 평가 받아요.
* IMM (irreversible morbidity and mortality): 치료가 불가능한 질환 혹은 사망
4. Mirdametinib의 임상시험 결과는 어땠나요?
Mirdametinib의 pivotal 연구는 임상 2b상 ReNeu trial이에요.

💡ReNeu 연구는 어떻게 설계되었나요?
ReNeu는 오픈라벨, 단일 그룹, 다기관, 임상 2b상 연구입니다.
오픈라벨(open-label)은 연구 참가자와 연구진 모두 어떤 치료를 받고 있는지 알고 있는 연구 방식을 의미해요. 단일 그룹(single group) 연구는 대조군 없이 실험군만 있는 방식입니다.
ReNeu 연구에는 58명의 성인(18세 이상) 및 56명의 소아(2-17세)가 참여했어요. 참가자들은 mirdametinib을 하루 2번 개인별 용량에 따라 복용했어요. 치료 1 cycle(=총 4주)은 3주 복용 - 1주 휴약하는 구성이고, 연구기간 동안 총 24 cycle 치료 단계를 거쳤어요.

💡Primary endpoint는 무엇이었나요?
Primary endpoint(일차 평가변수)는 확인된 객관적 반응률(confirmed ORR)이었어요.
* 객관적 반응률(objective response rate, ORR)이란?
해당 치료에 대한 완전 반응(CR) 또는 부분 반응(PR)을 보인 환자의 비율을 말해요. 고형암 치료제의 pivotal 연구에서 가장 흔하게 사용되는 지표입니다.
ReNeu 연구에서는 confirmed ORR을 다음과 같이 정의했어요:
(24 cycle 치료 후 baseline 대비) MRI 상의 총상신경섬유종(PN) 부피가 20% 이상 감소한 환자의 비율. 즉, 종양의 부피가 20% 이상 감소한 환자 비율을 의미해요.
결과는 어땠을까요?
성인 환자의 경우, 41%가 confirmed objective response를 달성하였어요.
이는 성인 환자에 있어 사전에 정의된 minimum clinically relevant response rate(= 임상적으로 의미있는 최소 반응률)인 23%보다 통계적으로 유의하게 높은 수치였어요. (P <0.001)

소아 환자에서는 52%가 confirmed objective response를 나타냈어요.
이 역시 사전에 정의한 null response rate(= 임상적으로 의미있는 최소 반응률) for children인 20%보다 통계적으로 유의하게 높은 결과였어요. (P <0.001)

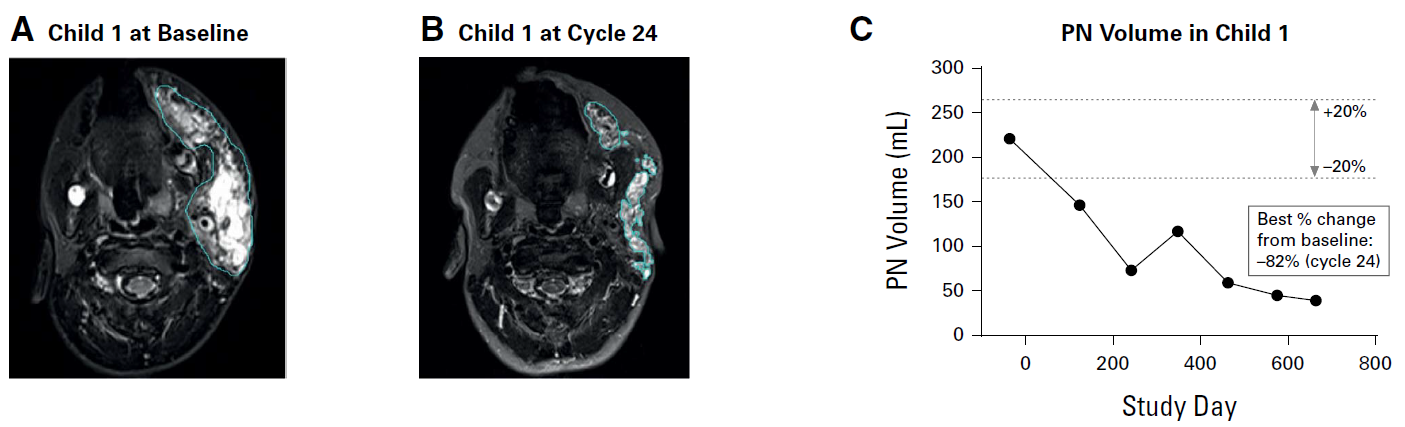
아래 그림은 논문에 발표된 한 소아 환자 예시입니다. 24 cycle 치료 후 baseline 대비 종양의 부피가 최대 82% 감소한 것을 볼 수 있어요.
💡Full Analysis vs. Per-Protocol 분석을 비교해볼게요.
위에 primary endpoint 결과를 보면서, 궁금한 점이 없으셨나요? 저는 밑줄 친 부분에 시선이 갔습니다.

그래서 Supplementary Data를 찾아봤어요.
아래 표를 보면, Full Analysis Set 결과와 Per-Protocol Set 결과가 비슷하지만 조금씩 다른 것을 알 수 있어요.
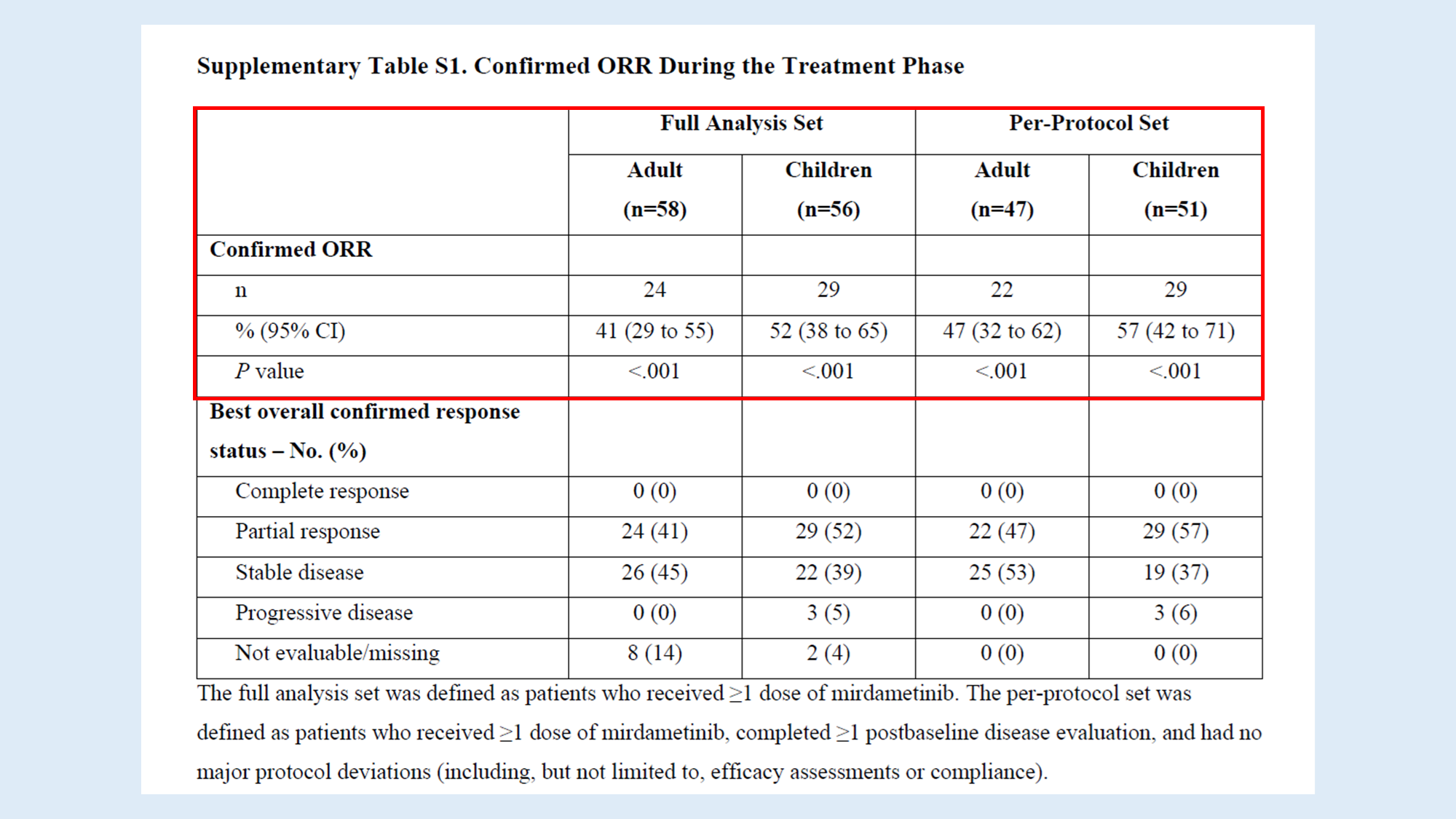
Full Analysis Set
Full Analysis Set는 Intention-to-Treat(ITT) 원칙에 기초한 분석군이에요.
ITT는 임상시험에 배정된 모든 참가자들을 분석 대상에 포함시키는 방법이에요. 쉽게 말해, 임상시험에 등록되어 최소 1회 이상 연구 약물을 투여받은 모든 환자를 포함한다는 것입니다.
ReNeu 연구에서는 Full Analysis Set 대상을 mirdametinib을 1회 이상 투여받은 모든 환자로 정의했어요. ITT 분석 결과는 실제 임상 현장과 좀 더 가깝다고 볼 수 있는데, 치료 중단이나 프로토콜 위반 등 현실적인 상황이 반영되어있기 때문이에요.
Per-Protocol Set
반면, Per-Protocol(PP)은 연구 프로토콜을 엄격히 준수한 환자들만 포함해요. ReNeu 연구에서는 PP 분석군을 다음과 같이 정의했어요:
- Mirdametinib을 1회 이상 투여 받고
- 약물 투여 후 정해진 절차에 따른 질병 평가를 1회 이상 완료했으며
- 주요 프로토콜 위반(효능 평가, 약물 복용 준수 등)이 없는 환자
Per-Protocol Set는 약물의 실제 "biological" 효과를 평가하는 데 유용해요. 프로토콜을 정확히 따랐을 때 약물이 보여주는 효과를 측정할 수 있기 때문입니다.
하지만 주의할 점도 있어요. PP 분석에는 "약물 부작용을 감당할 수 있고, 프로토콜을 끝까지 따른 사람들"의 데이터만 들어가기 때문에 일종의 선택 비뚤림(selection bias)이 있습니다.
아래 표를 보면 Full Analysis Set에는 성인 58명, 소아 56명이 포함되었지만, Per-Protocol Set에는 성인 47명, 소아 51명만 포함되었어요. 이는 일부 환자들이 프로토콜을 정확히 따르지 못했거나 기준치 이후 평가를 받지 못했기 때문입니다.
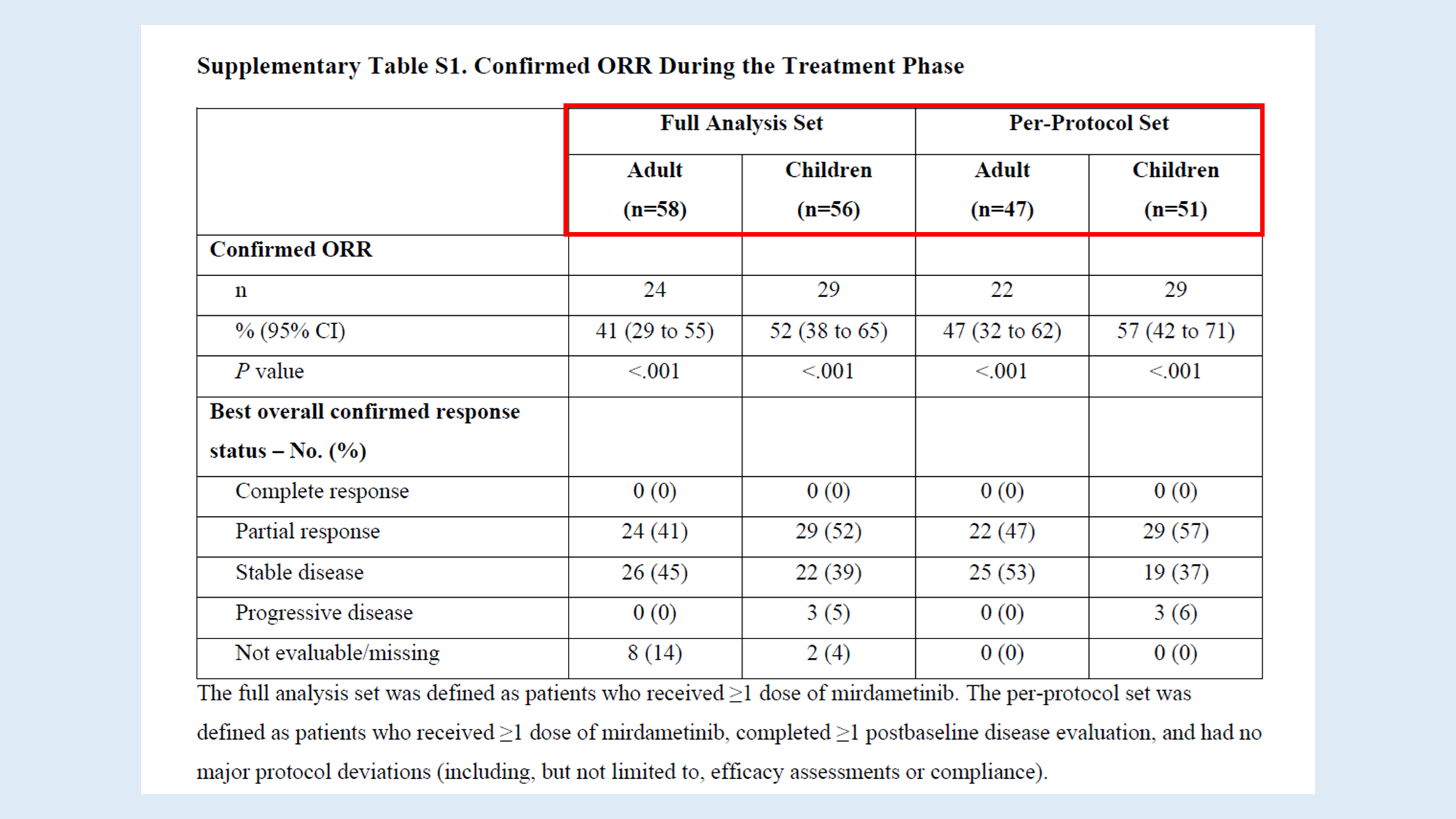
그럼에도 불구하고 두 양쪽 모두 comfirmed ORR에 큰 차이는 없었어요.
- 성인: 41%(Full Analysis) vs. 47%(Per-Protocol)
- 소아: 52%(Full Analysis) vs. 57%(Per-Protocol)
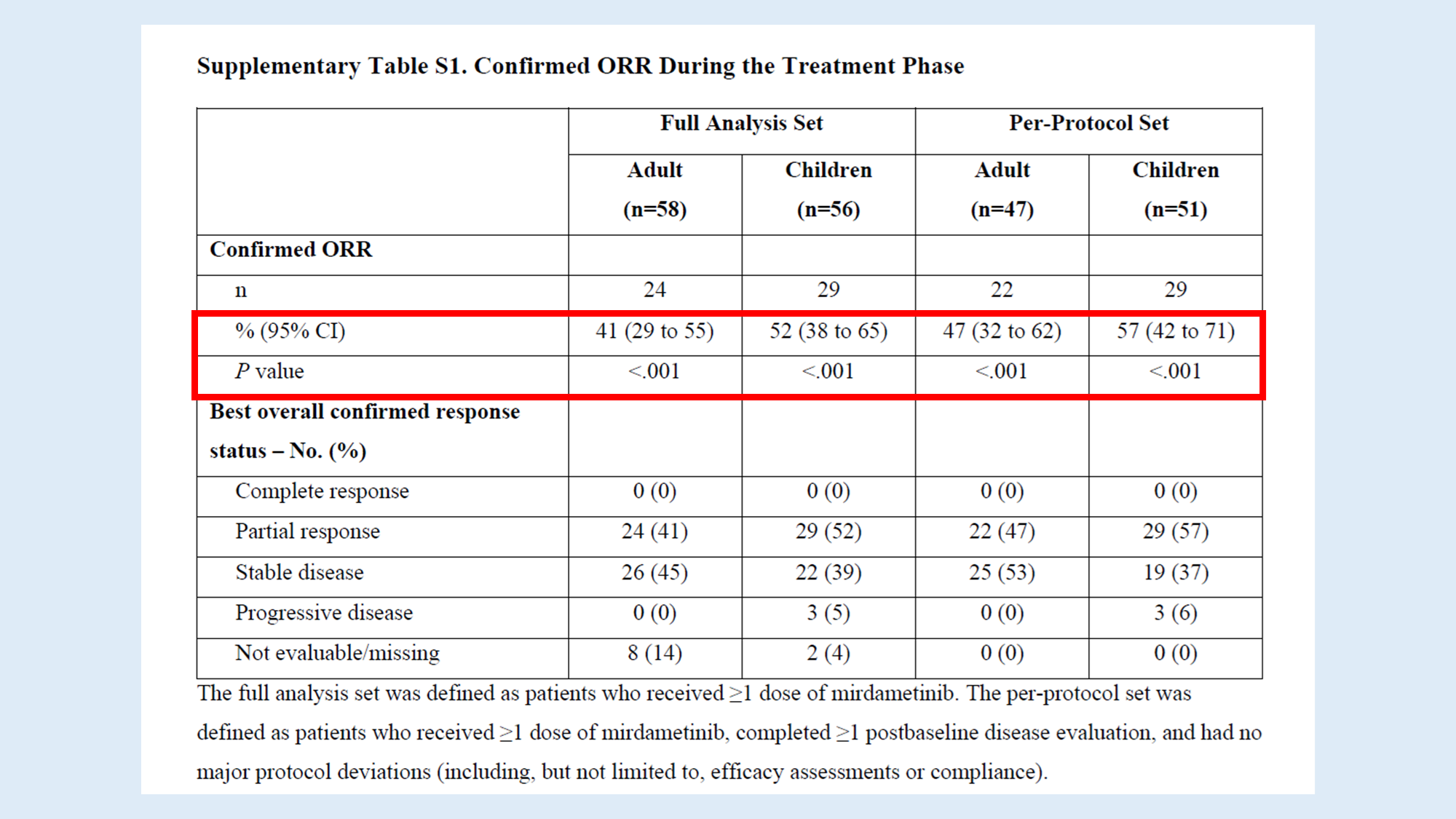
표에서 P value는 'Confirmed ORR'이 사전에 정의된 '최소 임상적 관련 반응률'보다 높은 지를 검증하는 값이에요. P <0.001이라는 수치는, 이 결과가 우연히 발생했을 확률이 0.1% 미만이라는 것을 의미해요. 즉, mirdametinib의 효과가 통계적으로 유의미하다는 근거입니다.
Full Analysis(ITT)와 Per-Protocol(PP) 두 분석법을 함께 사용함으로써, 약물의 효과에 대한 더 완전한 그림을 얻고, 결과의 일관성을 확인할 수 있어요.
💡'Best overall confirmed response status'는 무엇을 의미하나요?
Best overall confirmed response status는 '환자가 치료 기간 동안 보여준 가장 좋은 반응 상태'를 의미해요. 즉, 각 환자별로 치료 기간 전체를 통틀어 보였던 가장 긍정적인 반응 결과를 기록한 것이에요.
ReNeu 연구에서는 환자들을 5가지 카테고리로 분류했어요:
- Complete response(완전 반응, CR): 표적 총상신경섬유종(PN)이 완전히 사라짐
- Partial response(부분 반응, PR): Baseline 대비 표적 PN 크기가 20% 이상 감소함
- Stable disease: Baseline 대비 표적 PN 크기가 20% 미만 증가에서 20% 미만 감소 사이를 보임
- Progressive disease: 기준치에 비해 표적 PN 크기가 20% 이상 증가함
- Not evaluable/missing: 어떤 이유로든 평가할 수 없었음
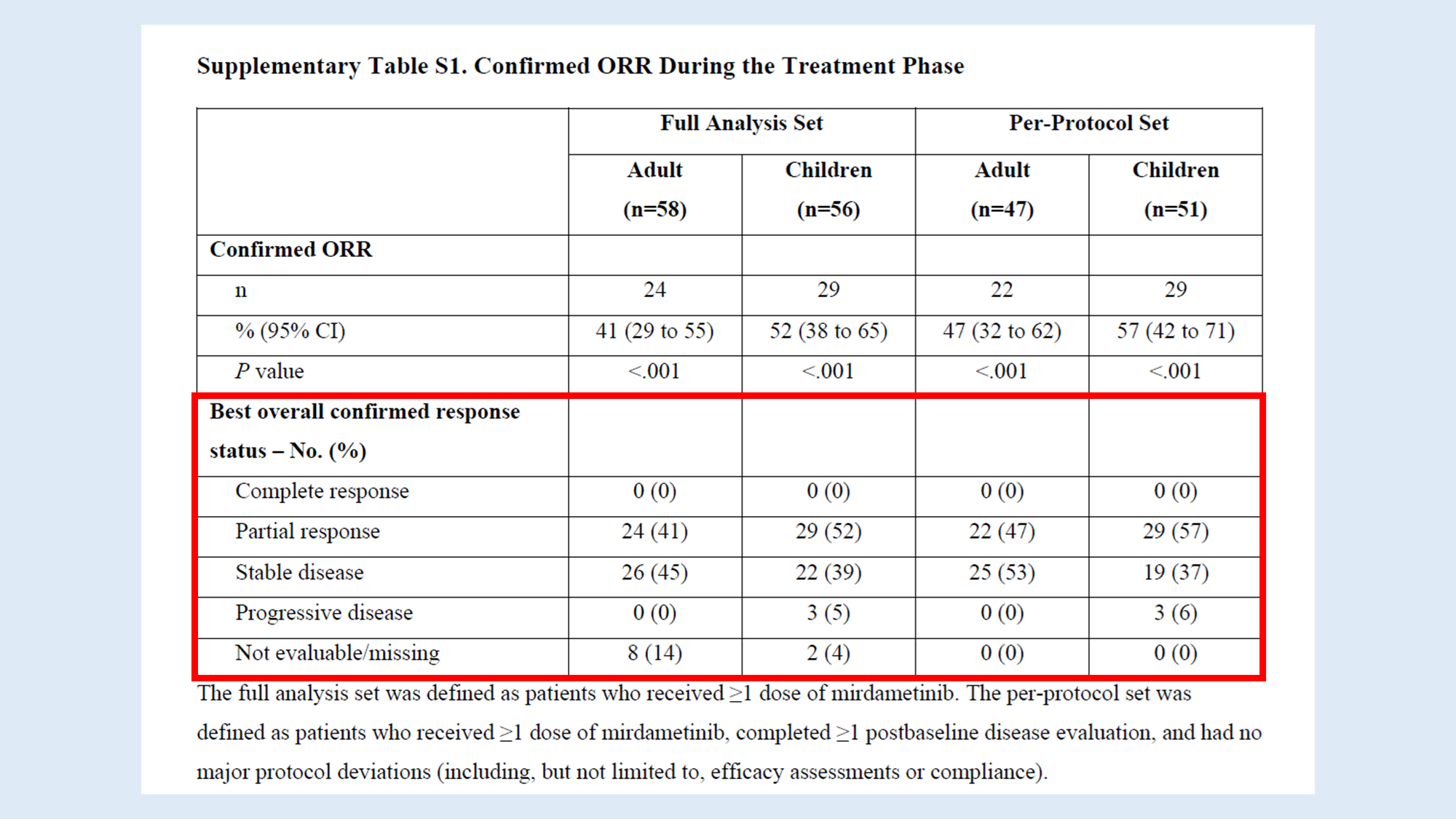
예를 들어, 어떤 환자가 처음에는 stable disease이었다가, 나중에 partial response(PR)을 보였다면, 그 환자의 best response는 PR로 기록됩니다.
ReNeu 연구에서는 CR에 도달한 환자가 없었기 때문에, response status 중 가장 좋은 결과는 PR였어요. CR이 가장 이상적이지만, 모든 종양학 연구에서 CR에 도달하는 건 드문 일입니다. 특히 PN과 같은 복잡한 질환에서는 PR도 상당히 의미 있는 결과이죠.
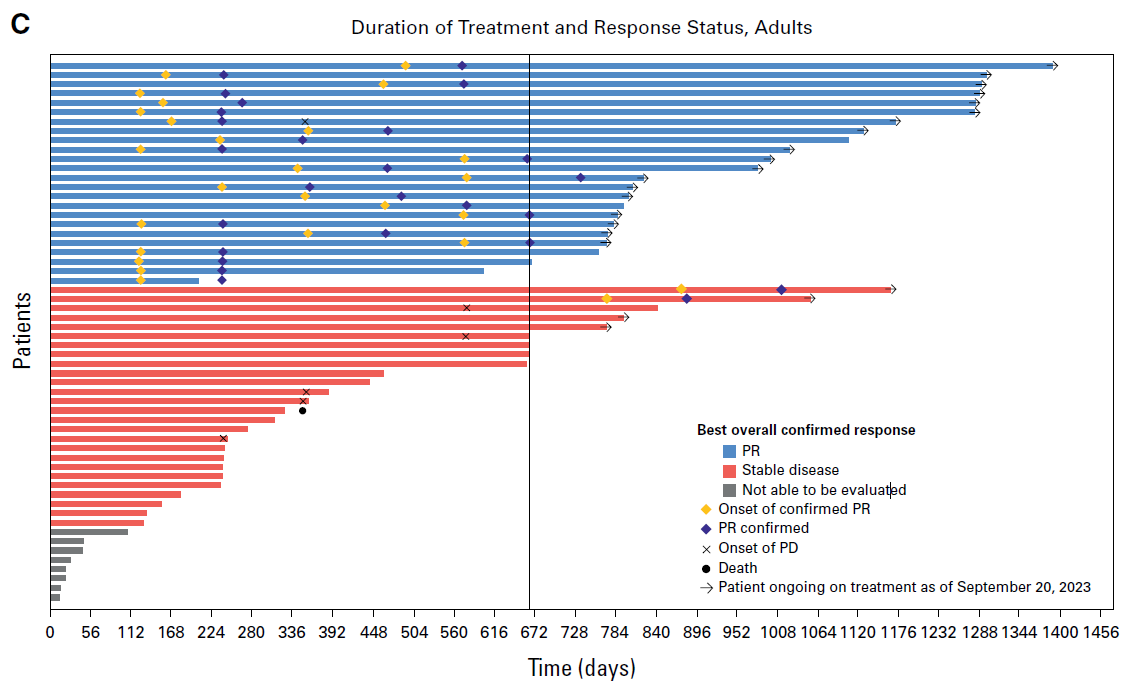
출처: J Clin Oncol. 43:716-729.
💡Safety 결과도 간략하게 알려주세요.
ReNeu 연구에서 mirdametinib은 전반적으로 관리 가능한 수준의 안전성 프로파일을 보였지만, 부작용 발생률은 높은 편이었어요. 성인 환자의 98%, 소아 환자의 95%에서 치료 관련 이상반응(TRAE)을 보였지만, serious TRAE는 성인 1명에서만 발생했습니다.
* TRAE = treatment-related adverse event
흔한 부작용은 다음과 같았어요:
- 성인: 여드름 모양 피부염(78%), 설사(48%), 구역(36%)
- 소아: 여드름 모양 피부염(43%), 설사(38%), 손발톱주위염(30%)
성인 환자의 안전성 데이터를 좀 더 자세히 살펴보면:
- 31%(18/58명)가 용량 조정이 필요했어요.
- 22%(13/58명)는 이상반응으로 인해 치료를 중단했어요.
전반적으로 mirdametinib은 MEK 억제제의 알려진 부작용과 일관된 프로파일을 보였으나, 면밀한 모니터링은 필수라고 생각됩니다.
오늘 내용을 정리했어요.
- Mirdametinib(상품명: Gomekli)는 NF1-PN을 겪고 있는 2세 이상 소아 및 성인을 대상으로 FDA 승인을 받은 최초이자 유일한 약물이에요. Orphan Drug, Fast Track, Priority Review 등 다양한 FDA 특별 프로그램의 지원을 받으며, 임상 2b상 결과를 토대로 최종 승인을 받았어요.
- Mirdametinib은 MAPK pathway의 핵심 효소인 MEK1과 MEK2를 억제하여 종양 세포의 성장을 막아요. ATP 비경쟁적 억제제로, 타겟 단백질인 MEK1/2에 대한 선택성을 높였어요.
- ReNeu 연구 결과를 해석하면서, ORR의 의미와 ITT 및 PP 분석의 차이점에 대해 설명했어요.
✅ 의학 논문을 검색하거나 임상 데이터를 해석할 일이 많으신가요?
✅ 임상 통계 개념을 대충 알긴 하는데.. 정확한 정의와 해석 방법을 알고 싶으신가요?
✅ Medical writing 관련 스펙을 쌓고 싶으신가요?
약토피아 임상통계 스터디, 6기 사전 알림을 신청해보세요!
약토피아 임상통계 스터디(a.k.a. 약통스)는 해외 유명 대학 강의를 듣고 수료증을 받는 스터디예요.
약통스 1~4기는 다양한 분야에 계신 분들이 참여해주셨어요.
- 약사 (약국, 병원, 제약회사, 식약처, 바이오벤처, MW 에이전시 등등)
- 간호사 (제약회사, CRO, MW 에이전시 등)
- 의사, 수의사, 한의사
- 응급구조사, 사업가, 약대/간호대 학부생, 타전공 석박사과정 등
임상 논문에 대한 이해를 높이고 싶은 분들은 누구나 참여 가능합니다.
* 약통스 5기는 모집이 마감되었어요.
Q. 스터디는 어떻게 진행되나요?
Coursera에 있는 여러 강의 중 예일 대학교에서 제공하는 'Understanding Medical Research'라는 강의를 온라인으로 수강해요. 이 강의는 Coursera에 있는 여러 강의들 중에서 가장 수강생이 많고 후기가 좋은 강의 중 하나입니다. 무료로도 수강할 수 있지만, 수료증을 받기 위해서는 $49를 지불하고 강의를 결제해야 해요.
Q. 강의를 무료로 들을 수 있는데, 왜 약토피아 임상통계 스터디에 참여해야 되나요?
크게 세 가지 장점이 있어요.
첫째. 스케줄링 및 동기부여
"혼자 들었으면 절대 끝까지 못 했을 거예요. 함께하는 힘을 느꼈어요."
1~4기 스터디원들이 공통적으로 하신 말씀입니다. 약통스에서는 총 3번에 걸친 수강 인증 절차를 통해 포기하지 않도록 스케줄링을 해드려요. 또한 서로 응원하고 격려하는 따뜻한 분위기에서 공부할 수 있어요.
둘째. 한글 가이드북
"참여비가 전혀 아깝지 않은 약토피아 가이드북!"
많은 분들이 가이드북 없이는 듣기가 어려웠을 거라고 확신하셨어요. 빠른 영어 강의라서 버거우신 분들을 위해 한글로 다 친절하게 정리했어요. 중간에 이해 못 하고 넘어가는 내용이 없도록 쉽게 풀어서 설명했어요. 100 페이지가 넘는 고퀄리티 가이드북이에요.
셋째. 다양한 네트워킹 기회
"알차지만 무겁지 않은 최고의 네트워킹"
[약토피아 네트워킹]은 2025년을 맞이하여 새롭게 추가된 약통스 참여 혜택입니다.
1~2달에 한 번씩 다양한 주제를 가지고, 소규모 네트워킹 모임을 정기적으로 개최합니다. 약통스 모든 기수분들이 함께 계시는 단톡방에서 공지를 드려요.
- 1월에는 ‘Medical Writer’를 주제로 네트워킹을 진행하였어요.
- 2월에는 ‘Clinical Trial 관련’을 주제로 참여자를 모집하였고, 3/6에 2번째 네트워킹이 예정되어 있습니다.
- 3월에는 ‘제약 마케팅’을 주제로 진행됩니다.

스터디에 관한 구체적인 설명과 압도적인 후기를 확인해보세요!








의견을 남겨주세요